- Fluorure d'hydrogène
-
 Cet article concerne le gaz fluorure d'hydrogène. Pour le fluorure d'hydrogène en solution, voir acide fluorhydrique.
Cet article concerne le gaz fluorure d'hydrogène. Pour le fluorure d'hydrogène en solution, voir acide fluorhydrique.Fluorure d'hydrogène 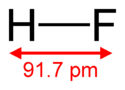
Molécule de fluorure d'hydrogèneGénéral Nom IUPAC acide fluorhydrique
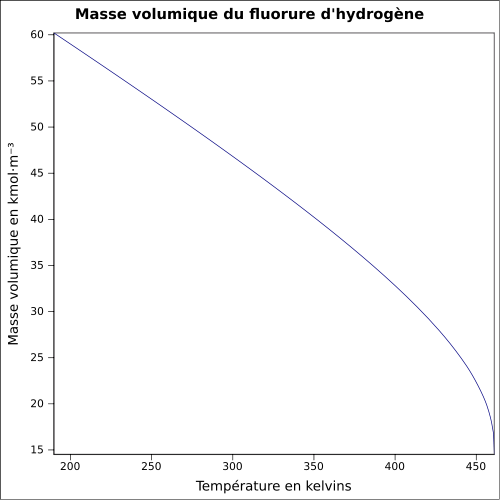
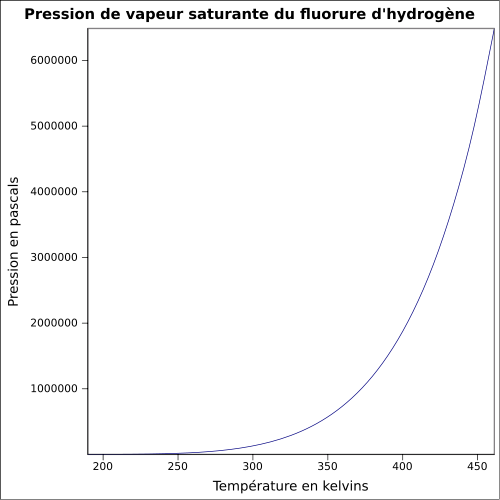
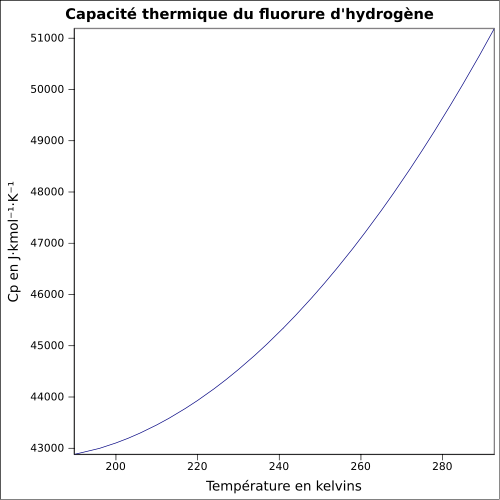
Fluorure d'hydrogèneNo CAS No EINECS Apparence gaz incolore ou liquide incolore, d'odeur acre[1]. Propriétés chimiques Formule brute HF [Isomères] Masse molaire[4] 20,00634 ± 7,0E-5 g·mol-1
H 5,04 %, F 94,96 %,Moment dipolaire 1,826178 D [2] Diamètre moléculaire 0,290 nm [3] Propriétés physiques T° fusion -83 °C[1] T° ébullition 20 °C[1] Solubilité dans l'eau : très bonne[1] Masse volumique 1,0 g·cm-3[1] T° d'auto-inflammation ininflammable Pression de vapeur saturante à 25 °C : 122 kPa[1] Point critique 64,8 bar, 187,85 °C [6] Thermochimie Cp Propriétés électroniques 1re énergie d'ionisation 16,044 ± 0,003 eV (gaz)[7] Propriétés optiques Indice de réfraction  1,340 [3]
1,340 [3]Précautions Directive 67/548/EEC 
T+
CPhrases R : 26/27/28, 35, Phrases S : 1/2, 7/9, 26, 36/37/39, 45, [8] Transport 886 1790 [9]NFPA 704 SIMDUT[10] 

SGH[11] 

DangerInhalation Très toxique Peau Très corrosif, Très toxique Yeux Très corrosif Ingestion Très toxique Écotoxicologie Seuil de l’odorat bas : 0,04 ppm[12] Unités du SI & CNTP, sauf indication contraire. Le fluorure d'hydrogène est un gaz incolore de formule chimique HF (un atome d'hydrogène (H) et un atome de fluor (F)). Il a une odeur piquante, il est très corrosif et très facilement liquéfiable.
Théoriquement, le fluorure d'hydrogène devrait être un gaz difficilement liquéfiable or il est liquide à température ambiante. Cette anomalie est due au fait que le fluorure d'hydrogène se présente sous forme dimérisée (HF)2.
Sommaire
Chimie
La molécule de fluorure d’hydrogène HF est une molécule diatomique constituée d’un atome d’hydrogène H et d'un atome de fluor F, liés par une liaison simple. Le fluor étant nettement plus électronégatif que l’hydrogène, la liaison est très polarisée. En conséquence, la molécule porte un moment dipolaire important, avec une charge partielle négative δ- portée par l’atome de fluor et une charge partielle positive δ+ portée par l’atome d’hydrogène. Le fluorure d’hydrogène est donc une molécule polaire. Elle est très soluble dans l’eau et dans les solvants polaires. La dissolution du fluorure d'hydrogène dans l'eau est une réaction exothermique violente qui doit être réalisée avec précaution, car des projections peuvent avoir lieu.
Préparation
Le fluorure d'hydrogène est synthétisé à partir de fluorure de calcium mélangé à de l'acide sulfurique.
- CaF2 + H2SO4 → CaSO4 + 2 HF
Les vapeurs obtenues par cette réaction sont un mélange de fluorure d'hydrogène, d'acide sulfurique et d'autres produits en faible quantité. Le fluorure d'hydrogène peut être isolé par distillation.
Il peut aussi être synthétisé par oxydation de l'eau par le difluor, avec comme intermédiaire l'acide hypofluoreux. Ce dernier, très instable, se décompose spontanément de façon explosive en fluorure d'hydrogène et dioxygène.
Utilisation
L'acide fluorhydrique et le fluorure d'hydrogène sont des précurseurs importants dans la synthèse de nombreux composés comme les produits pharmaceutiques et les polymères (Teflon). Le fluorure d'hydrogène est aussi très utilisé dans l'industrie pétrolière et dans la composition de superacides.
Sécurité
Le fluorure d'hydrogène est un gaz ininflammable mais il réagit avec la plupart des métaux en présence d'humidité pour former du dihydrogène, un gaz très inflammable. La réaction avec les alcalis peut être très violente.
Le fluorure d'hydrogène est un gaz plus lourd que l'air et il peut s'accumuler sous le sol ou dans des endroits confinés. Il doit être stocké dans un endroit ventilé afin d'éviter des risques. Dans une atmosphère humide, il dégage des vapeurs blanches. L'absorption excessive d'ions fluorure peut provoquer une fluorose aiguë.
Il réagit aussi avec l'eau pour former de l'acide fluorhydrique, un acide très corrosif. Ce produit ne doit pas être rejeté dans l'environnement car il modifie le pH de l'eau.
Liens externes
Voir aussi
Références
- FLUORURE D'HYDROGENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- « fluorure d'hydrogene » sur ESIS, consulté le 11 février 2009
- Entrée du numéro CAS « 7664-39-3 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 novembre 2008 (JavaScript nécessaire)
- « Fluorure d’hydrogène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Hydrogen fluoride sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
Catégories :- Produit chimique très toxique
- Produit chimique corrosif
- Acide halogénohydrique
- Fluorure
- Gaz inorganique
Wikimedia Foundation. 2010.