- Effet inductif
-
Au sein d'un composé chimique, l'effet inductif consiste en la propagation d'une polarisation électronique au fil des liaisons chimiques, due à la différence d'électronégativité des différents éléments liés entre eux.
Sommaire
Électronégativité
Définition
L'électronégativité est la capacité d'un élément à attirer les électrons, donc leur charge électrique, lorsqu'il est lié à un autre atome. L'électronégativité est relative : un élément A est électronégatif par rapport à un autre élément B si A attire de façon plus forte les électrons, B sera alors dit électropositif par rapport à A. L'électronégativité est généralement notée χ.
Molécule A2
Dans une molécule de type A2 la liaison des deux atomes A est purement covalente : les électrons sont équitablement répartis au sein de la liaison puisqu'il n'y a pas de différence d'électronégativité. Les deux atomes A sont donc électriquement neutres. Deux éléments A et B ayant la même électronégativité seront aussi liés par une liaison purement covalente, et électriquement neutre. La molécule A-A n'est donc pas polarisée.
Molécule A-B
Dans une molécule de type A-B, où l'électronégativité des deux éléments A et B est différente, la liaison A-B est iono-covalente. Les électrons ne sont pas équitablement répartis puisque l'élément ayant l'électronégativité la plus élevée va attirer les électrons. Les deux atomes sont partiellement chargés. Plus la différence d'électronégativité est élevée, plus les charges partielles sont importantes. Ces deux charges sont dites partielles car ce sont des fractions (comprises entre 0 et 1), positives ou négatives, de la charge élémentaire. Elles sont généralement notées δ+ ou δ-. On parle alors de degré d'ionicité de la liaison (ou à l'inverse de degré de covalence).
Par exemple, si χB > χA, alors B sera partiellement chargé négativement puisqu'il attire les électrons, A sera au contraire partiellement chargé positivement. Par ailleurs, la liaison A-B est polarisée.
Moment dipolaire électrique
Lorsque deux atomes A et B sont liés et partiellement chargés électriquement, on constate qu'il existe un moment dipolaire, noté
 . Ce moment dipolaire va de l'atome chargé positivement à l'atome chargé négativement (la convention inverse est utilisée en physique).
. Ce moment dipolaire va de l'atome chargé positivement à l'atome chargé négativement (la convention inverse est utilisée en physique).Le moment dipolaire d'un composé est la somme vectorielle des moments dipolaires qui existent entre chaque liaison. C'est la valeur de ce moment dipolaire qui est mesuré expérimentalement, il est très difficile de calculer la valeur du moment dipolaire d'un composé (ce calcul prend en compte le barycentre des charges partielles de chaque atome, difficilement calculables et positionnables dans l'espace), l'unité de mesure usuelle est le Debye.
Effet inductif – cas général
Définition
Lorsque deux atomes A et B, d'électronégativités différentes, sont liés il y a déplacement des électrons vers le composé le plus électronégatif, polarisation de la liaison, les atomes A et B sont alors partiellement chargés et il y a donc un moment dipolaire électrique. La polarisation de la liaison, et ses conséquences, est appelée effet inductif.
Il peut aussi y avoir effet inductif lorsqu'un atome A est lié à un groupe d'atomes globalement électroattracteur (et inversement, si A est plus électroattracteur). A sera alors chargé partiellement positivement (et inversement, A sera chargé partiellement négativement).
Plus la différence d'électronégativité entre les éléments en présence est importante, plus la polarisation de la liaison sera importante, et plus l'effet inductif sera important.
Propagation
Globalement, au sein d'un composé chimique, l'effet inductif se transmet le long des liaisons σ. On considère généralement que l'effet inductif, dû à un élément très électronégatif (ou électropositif), devient négligeable, voire inexistant, après une suite de trois liaisons σ. Ceci explique que l'effet inductif peut aussi être dû à un groupement d'atomes. Les liaison pi, en raison de leur forte densité en électrons, sont plus aptes a transmettre l'effet inductif d'un atome ou d'un groupe d'atomes. En effet, une liaison double sera plus facilement polarisable, et donc le déficit ou excédent d'électron sera d'autant plus marquée d'un bout a l'autre de la liaison.
Addition
Les effets inductifs peuvent s'additionner. Ainsi dans un composé du type B-A-B, avec χB > χA, on aura δA = -2δB (δB < 0 et δA > 0 ). En fait A bénéficie deux fois de l'effet inductif de B.
Dans le dioxyde de carbone (CO2) le carbone bénéficie deux fois de l'effet inductif des atomes d'oxygène, élément plus électronégatif que le carbone.
Le même raisonnement s'applique pour un composé du type A-B-C, ou les électronégativités des trois éléments sont différents. Les réactifs de Grignard sont un bon exemple de ce type de composés. Les réactifs de Grignard sont des organomagnésiens mixtes, du type C-Mg-X, avec X un halogène (généralement le chlore). Le magnésium est plus électropositif que le carbone qui porte donc une charge partielle légèrement négative. Les réactifs de Grignard sont très utilisés en chimie organique, notamment pour la synthèse d'alcanes non-linéaires.
Effet inductif donneur – attracteur
Si par effet inductif un atome A au sein d'un composé est partiellement chargé négativement (si le moment dipolaire dû à cet effet inductif part vers A depuis l'atome -ou le groupe d'atomes- moins électroattracteur), on parle d'effet inductif attracteur, parfois noté -I.
À l'inverse, si par effet inductif un atome A au sein d'un composé est partiellement chargé positivement (si le moment dipolaire dû à cet effet inductif part de l'atome vers A -ou le groupe d'atomes- plus électroattracteur), on parle d'effet inductif donneur, parfois noté +I.
Conséquences générales de l'effet inductif
Réactivité
Par effet inductif, un atome A au sein d'un composé chimique devient partiellement chargé électriquement, soit positivement, soit négativement. Cette charge partielle peut modifier la réactivité de A, et par conséquent des atomes qui lui sont directement liés.
Ainsi, si A est partiellement chargé positivement il attirera des composés chargés négativement, ou ayant un excès d'électrons, et réagira plus facilement avec ces composés. Si A bénéficie d'un effet inductif attracteur, A sera électrophile. Un groupement -I est donc activant pour les réactions nucléophiles, désactivant pour les réactions électrophiles.
De même, si A est partiellement chargé négativement il attirera des composés chargés positivement, ou ayant un déficit en électrons, et réagira plus facilement avec ces composés. Si A bénéficie d'un effet inductif donneur, A sera nucléophile. Un groupement +I est donc activant pour les réactions électrophiles, désactivant pour les réactions nucléophiles.
Stabilité des ions
Les ions sont des composés chimiques qui ont un excès (ou un défaut) de charges électriques. De ce fait, ils sont notoirement réactifs, donc peu stables. Or l'effet inductif charge électriquement les atomes au sein de composés chimiques.
Si par effet inductif on compense la charge électrique de l'ion, celle-ci sera moins importante et l'ion sera donc plus stable. Inversement, si par effet inductif on rend la charge de l'ion encore plus importante, il sera plus instable.
Effet inductif en chimie organique
Particularités
Les composés organiques sont principalement formés de carbone et d'hydrogène. En chimie organique, les éléments autres que le carbone et l'hydrogène sont des hétéroatomes ; les atomes (ou groupes d'atomes) différents de l'hydrogène liés à un carbone sont appelés substituants.
On parlera donc particulièrement d'effet inductif attracteur, ou donneur, d'un substituant par rapport au carbone.
Notation : dans les formules chimiques les substituants notés R sont soit des groupements alkyles, soit des hydrogène.
Substituants à effet attracteur (-I)
Les substituants à effet inductif attracteur, noté -I, sont des substituants qui ont une électronégativité plus élevée que celle du carbone. Une grande partie des hétéroatomes rencontrés en chimie organique ont un effet inductif attracteur. Ci-dessous une liste non exhaustive des principaux substituants à effet -I rencontrés en chimie organique :
- substituants halogénés :
- -CF3, le groupement trifluorométhyle ;
- -CCl3, le groupement thichlorométhyle ;
- et plus généralement tout groupement possédant un ou plusieurs halogènes, ou l'halogène lui-même
- subsituants azotés :
- substituants possédant un oxygène :
- substituants carbonés (alcyles ou allyles) :
Substituants à effet donneur (+I)
Les substituants à effet inductif donneur, noté +I, sont des substituants qui ont une électronégativité inférieure à celle du carbone, et de l'hydrogène. Relativement peu d'hétéroatomes (les alcalins et les alcalino-terreux) ont un effet inductif donneur. Ci-dessous une liste non exhaustive des principaux substituants à effet +I rencontrés en chimie organique :
- les alcalins ou alcalino-terreux:
- -Na, le sodium;
- -Li, le lithium;
- -MgR, les organo-magnésiens;
- les boranes
- -BRR'
- et les groupements alkyles
Acidité des acides carboxyliques
Les acides sont caractérisés selon leur force par une constante d'acidité, le pKa. Plus le pKa est faible, plus l'acide est fort.
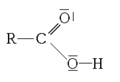
Les acides carboxyliques sont des composés organiques du type R-COOH.
RCOOH + H2O ⇔ RCOO- + H3O+
Si R est un groupement attracteur (-I) la polarité de la liaison O-H est plus importante, l'hydrogène est donc moins attaché à l'oxygène et est plus facilement détachable. L'acide est alors plus fort, et le pKa plus faible. Le raisonnement est aussi applicable à la forme basique. L'effet inductif compense légèrement la charge négative de RCOO- qui est alors plus stable, donc plus présent en solution aqueuse, l'équilibre de dissociation de l'acide est déplacé vers la droite : l'acide est plus fort.
À l'inverse, si R est un groupement donneur (+I), la liaison O-H est moins polarisée et l'hydrogène plus difficile à arracher. L'acide est alors plus faible, et le pKa plus élevé.
Stabilité des carbocations
Article détaillé : carbocation.Les carbocations sont des intermédiaires de réaction, chargés positivement au niveau d'un carbone. La stabilité des carbocations définit quel produit de réaction sera obtenu en majorité. C'est donc un facteur important dont il faut tenir compte pour de nombreuses réactions organiques faisant ayant de tels intermédiaires. Les carbocations sont stabilisés par effet inductif donneur, donc généralement par la présence de groupements alkyles. Un carbocation tertiaire (le carbone chargé est lié à trois autres carbones) sera plus stable qu'un secondaire, lui-même plus stable qu'un primaire.
Voir aussi
Catégories :- Chimie organique physique
- Liaison chimique
- substituants halogénés :
Wikimedia Foundation. 2010.