- 10028-15-6
-
Ozone
 Pour le groupe de musique moldave, voir O-Zone.
Pour le groupe de musique moldave, voir O-Zone.Ozone 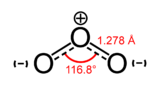
Général Nom IUPAC Trioxygène Synonymes ozone No CAS No EINECS SMILES InChI Apparence gaz incolore ou bleuatre, d'odeur caracteristique.[1] Propriétés chimiques Formule brute O3 [Isomères] Masse molaire 47,9982 g∙mol-1
O 100 %,Propriétés physiques T° fusion -192,5 °C[2] T° ébullition -111,9 °C[2] Solubilité dans l'eau à 0 °C : 0.1 g/100 ml[1] Masse volumique 2,144 g/l (0 °C) Précautions Directive 67/548/EEC [2] 
T+
C
OSIMDUT[3] 



Unités du SI & CNTP, sauf indication contraire. L’ozone (ou trioxygène) est un composé chimique comportant 3 atomes d’oxygène (O3). Sa structure est une résonance entre trois états. Métastable aux conditions ambiantes, l’ozone a tendance à se décomposer naturellement en dioxygène. À température ambiante, c’est un gaz bleu pâle. Il se liquéfie à -111,9 °C sous forme d’un liquide bleu foncé particulièrement instable et se solidifie à -192,5 °C.
Sommaire
Chimie
L'ozone est produit par décharge électrique dans du dioxygène. Il réagit avec les métaux alcalins et métaux alcalino-terreux pour former des ozonides (
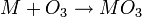 ), instables et réagissant avec l’eau pour former du dioxygène. Cette succession de réactions chimiques explique pour la plus grande part le caractère de polluant qui est attribué à l’ozone quand celui ci est présent dans l’atmosphère près du sol.
), instables et réagissant avec l’eau pour former du dioxygène. Cette succession de réactions chimiques explique pour la plus grande part le caractère de polluant qui est attribué à l’ozone quand celui ci est présent dans l’atmosphère près du sol.Contrairement au dioxygène inodore, l’ozone est perçu par l’odorat humain ; son odeur est très caractéristique, légèrement piquante. Respiré en grande quantité, il est toxique. Cela fait tousser.
Découverte
L'ozone a été découvert pour la première fois en 1781 par Martin von Marum puis la molécule fut isolée en 1839 par le chimiste suisse Christian Friedrich Schönbein. Il le dénomma ainsi en se référant à la racine grecque ozein (exhaler une odeur, sentir). La relation entre l’ozone et les oxydes d’azote a été mise en évidence dans les années 1970 par Paul Josef Crutzen, prix Nobel de chimie 1995.
Dans l'atmosphère
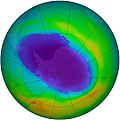
Article détaillé : Couche d'ozone.Dans la haute atmosphère terrestre, la couche d’ozone est une concentration d’ozone qui filtre une partie des rayons ultraviolets émis par le Soleil, ultraviolets notamment responsables de cancers de la peau. Cette couche protectrice est menacée par la pollution, en particulier par les émissions de gaz CFC (Chlorofluorocarbone), qui montent dans la haute atmosphère et y catalysent la destruction de l’ozone en le transformant en dioxygène, étant ainsi à l’origine du trou dans la couche d’ozone. Comme instrument de mesure, on peut noter l’instrument GOMOS du satellite ENVISAT.
Article détaillé : Ozone troposphérique.L’ozone est aussi très présent autour des grandes agglomérations qui en fournissent les précurseurs, notamment le dioxyde d’azote NO2, par leur pollution atmosphérique. Lors des canicules, on trouve l’ozone en grande quantité dans les basses couches de l’atmosphère, surtout autour des centres urbains. Il y est principalement produit par la réaction des hydrocarbures imbrûlés et des oxydes d’azote des gaz d’échappement des véhicules avec l’oxygène de l’air sous l’influence de la lumière solaire. De même, les incendies de forêt en sont aussi une source importante, à partir des hydrocarbures et des oxydes d’azote qu'ils libèrent. Sous le vent de ces feux, sur de longues distances, les taux d'ozone peuvent tripler et dépasser les seuils recommandés[4]. Lors de fortes températures, la dispersion de l'ozone vers les couches supérieures de l’atmosphère est freinée, induisant éventuellement des problèmes de santé chez les personnes fragiles. L'ozone est en outre produit avec les éclairs de l'orage ainsi que, plus généralement, à partir de toute étincelle ou arc électrique. La photocopieuse dégage de l'ozone et peut-être à l'origine de concentrations dans un local mal ventilé.
Production industrielle
À l’échelle industrielle, l’ozone est produit en utilisant des radiations ultraviolettes de courtes longueurs d’ondes émises par une lampe à vapeurs de mercure ou par le procédé de décharge à froid (décharge corona) qui utilise un champ électrique élevé. L’appareil de décharge est constitué de deux plaques de métal séparées par une couche d’air et un isolant électrique de constante diélectrique élevée, comme le mica ou un verre borosilicaté. Une différence de potentiel élevée est appliquée entre les deux plaques, ce qui entraîne la dissociation des molécules d’oxygène de la couche d’air et leur recombinaison en ozone. Une couronne peut être présente mais le champ électrique est maintenu à une valeur inférieure à celle qui entraînerait l’apparition d’un arc électrique et d’un plasma.
En laboratoire, l’ozone peut être produite par électrolyse en utilisant une batterie de 9 V, une cathode de graphite, une anode de platine et l’acide sulfurique comme électrolyte. Les demi-réactions qui ont lieu sont :
- 3H2O → O3 + 6H+ + 6e- ΔEo = -1,53 V
- 6H+ + 6e- → 3H2 ΔEo = 0 V
- 2H2O → O2 + 4H+ + 4e- ΔEo = -1,23 V
Trois équivalents d’eau sont utilisés pour produire un équivalent d’ozone. Cette réaction est en compétition avec celle de formation d’oxygène.
Utilisation dans le traitement de l'eau
Purification de l'eau potable
L’ozone présente une série d’avantages par rapport au chlore mais ne permet pas de détruire tous les micro-organismes présents dans l'eau (comme les parasites cryptosporidium, giardia, toxoplasmose… responsables d'épidémies meurtrières ces dernières années). Il est cependant employé, et ce, malgré le coût souvent significatif d’une installation d’ozonisation de l’eau. Ces avantages sont les suivants :
- il ne reste pas présent dans l’eau ;
- il ne provoque pas l’apparition de produits organochlorés, qui peuvent être cancérigènes ;
- il ne laisse pas de mauvais goût peu apprécié des consommateurs d’eau potable.
L’ozone est employé dans le traitement de l’eau pour plusieurs fonctions :- oxydation du fer ;
- amélioration de la performance de filtres à sable ;
- amélioration de la floculation (appelée « ozofloculation ») ;
- désinfection de l’eau (attention toutefois au risque de contamination par les parasites cryptosporidium) ;
- élimination de composés organiques nocifs, en particuliers pesticides et herbicides. Pour cette application l’ozone est en général injecté en amont d’un filtre à charbon.
L'ozone est utilisé par la ville de Nice depuis maintenant 1907 (première usine au monde purifiant l'eau par l'ozone à Bon-Voyage et après à Rimiez). Il est possible de visiter le site ayant un patrimoine historique des plus intéressants.
L'ozone a permis à la ville de Marseille et de son agglomération d'être classée, à partir des normes de l'Organisation Mondiale de la Santé(O.M.S), par le magazine:ça m'intéresse: Première ville de France pour la qualité de son eau.
L'ozone est devenue une référence de qualité pour l'eau potable dans beaucoup de communes et de villes à travers le monde.
Eaux usées
L’ozone est utilisé dans des procédés de traitement des eaux usées, en particulier pour rendre digestible par des bactéries la DCO dite « dure », pour le traitement de la couleur, et pour la désinfection de l’eau en sortie de stations d’épuration (traitement dit tertiaire).
Ces applications nécessitent la maîtrise de plusieurs techniques : ozonisation, mais aussi bio-réacteurs. Parfois la performance de l’ozone peut être améliorée en combinant l’ozonisation par un traitement UV à haute dose d’irradiation. On parle alors de procédés d’oxydation avancés.Utilisations industrielles
- Importance
L’utilisation de l’ozone dans le traitement de l’eau reste actuellement l’application industrielle prévalente. Toutefois une série d’autres applications ont été développées au cours des 2 dernières décennies, essentiellement en substitution du chlore.
- Motivations
L’ozone est un oxydant et un désinfectant puissant. Il présente certains avantages par rapports à d’autres oxydants habituellement utilisés dans l’industrie, en particulier le chlore. Le principal avantage est l’absence de rémanence : l’ozone étant chimiquement instable, il ne reste pas de traces d’oxydant ou de produits dérivés sur les produits traités.
- Blanchisserie
Cette application est très répandue dans les pays anglo-saxons et peu en Europe continentale. L’ozone est utilisé essentiellement pour le lavage de linge blanc dans les installations commerciales.
- Industrie agro-alimentaire
L’ozone est employé dans l’agroalimentaire pour deux applications bien distinctes :
- l’ozonisation de chambres froides ;
- le lavage de produits alimentaires à l’eau ozonée.
- Micro-électronique
Les wafers destinés à la fabrication de circuits intégrés sont lavés avec de l’eau ozonée avec pour objectif l’élimination de traces éventuelles de matière organique.
- Papeterie
L'ozone est employé comme blanchissant alternatif au chlore, et pour le traitement des eaux usées de papeterie.
- Nettoyage des conduites
L'eau ozonée est un moyen simple à mettre en œuvre pour la destruction de biofilms dans des conduites.
Notes et références
- ↑ a et b OZONE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b et c Entrée du numéro CAS « 10028-15-6 » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 18 janvier 2009 (JavaScript nécessaire)
- ↑ « Ozone » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ (en) Impacts of the fall 2007 California wildfires on surface ozone: integrating local observations with global model simulations, Gabriele Pfister et al., Geophysical research letters (consulté le 23 octobre 2008)
Voir aussi
Articles connexes
Liens externes
- Fiche internationale de sécurité
- Fiche toxicologique de l’INRS
- (fr) Pollution de l’air par l’ozone et santé résumé de GreenFacts de rapports scientifiques de l’OMS
- Prévision de l’ozone Prévisions et observations de la qualité de l’air en France et en Europe
- (en) International Ozone Association - European African Asian Australasian Group
- Manuel de purification de l’eau, ebook (contient une section sur la mesure de l’ozone et l’utilisation de l’ozone en traitement de l’eau)
- Association des médecins suisses pour l’utilisation thérapeutique de l’ozone
- L’histoire de l’ozone révélée par des spores fossiles, futura-sciences.com
- Portail de la chimie
- Portail de l’environnement et du développement durable
- Portail de la météorologie
- Portail de l’aéronautique
Catégories : Produit chimique très toxique | Produit chimique corrosif | Produit chimique comburant | Circulation atmosphérique | Atmosphère | Gaz à effet de serre | Composé de l'oxygène | Changement climatique
Wikimedia Foundation. 2010.