- 1-bromobutane
-
1-bromobutane 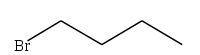
Général Nom IUPAC 1-Bromobutane No CAS No EINECS SMILES InChI Propriétés chimiques Formule brute C4H9Br [Isomères] Masse molaire[3] 137,018 ± 0,005 g·mol-1
C 35,06 %, H 6,62 %, Br 58,32 %,Moment dipolaire 2,08 ± 0,10 D [1] Diamètre moléculaire 0,566 nm [2] Propriétés physiques T° fusion -112,4 °C[4] T° ébullition 102 °C[4] Solubilité presque insoluble dans l'eau (0,6 g·l-1), soluble dans l'éthanol, l'éther Masse volumique 1,2686 g·cm-3 à 20 °C[5] T° d'auto-inflammation 265 °C[4] Point d’éclair 13 °C[4] Limites d’explosivité dans l’air 2,6–6,6 %vol[4] Pression de vapeur saturante 43 mbar à 20 °C
68 mbar à 30 °C
175 mbar à 50 °C[4]Thermochimie Cp Propriétés optiques Indice de réfraction  1,437 [2]
1,437 [2]Précautions Directive 67/548/EEC [4] 
Xi
F
NPhrases R : 11, 36/37/38, 51/53, Phrases S : 16, 26, 61, Transport 33 1126 NFPA 704 SIMDUT[7] 
Composés apparentés Isomère(s) 2-Bromobutane Autres composés 1-Chlorobutane
1-IodobutaneUnités du SI & CNTP, sauf indication contraire. Le 1-bromobutane (CH3CH2CH2CH2Br) est un dérivé halogéné du butane, ou l'un des atomes d'hydrogène (fixé sur un atome de carbone primaire) a été substitué par un atome de brome. C'est un halogénure d'alkyle primaire.
En conditions normales, il se présente sous la forme d'un liquide incolore, insoluble dans l'eau, mais soluble dans l'éthanol et l'éther.
Sommaire
Production et synthèse
Le 1-bromobutane peut être synthétisé par substitution nucléophile du butan-1-ol par l'acide bromique, le tribromure de phosphore ou encore le bromure de sodium.
Utilisation
En tant qu'halogénure d'alkyle primaire, le 1-bromobutane réagit spécifiquement par des réactions de type SN2. Il est couramment utilisé comme réactif pour des réactions d'alkylation, ou transformé en organomagnésien par réaction avec le magnésium dans l'éther pour former des liaisons carbone-carbone.
Le 1-bromobutane peut aussi être utilisé pour synthétiser d'autre composés organométalliques, comme le n-butyllithium:[8]
- 2 Li + C4H9Br → C4H9Li + LiBr
Le lithium utilisé pour cette réaction contient en général entre 1 et 3 % de sodium. Lorsque le bromobutane est utilisé comme réactif, le produit final est une solution homogène, constituée de clusters mélant bromure de lithium (LiBr) et butyllithium (LiBu).
Sécurité
Les vapeurs de 1-bromobutane peuvent former avec l'air un mélange explosif (point d'éclair 13 °C, température d'auto-inflammation 265 °C). Il convient donc de le conserver à l'abri de l'air.
Voir aussi
- Chlorobutane
- 2-bromobutane
Notes et références
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « 1-Brombutane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 25 mars 2009 (JavaScript nécessaire)
- fiche sur la CSST
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co. (ISBN 0-88415-857-8)
- « Bromo-1 butane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Brandsma, L.; Verkraijsse, H. D., Preparative Polar Organometallic Chemistry I, Berlin, Springer-Verlag, 1987 (ISBN 978-3-540-16916-1)
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « 1-Brombutan » (voir la liste des auteurs)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « 1-Bromobutane » (voir la liste des auteurs)
Catégories :- Produit chimique irritant
- Produit chimique facilement inflammable
- Produit chimique dangereux pour l'environnement
- Bromoalcane
Wikimedia Foundation. 2010.





