- 1-Bromobutane
-
1-bromobutane
1-bromobutane 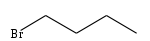
Général Nom IUPAC 1-Bromobutane No CAS No EINECS SMILES InChI Propriétés chimiques Formule brute C4H9Br [Isomères] Masse molaire 137,018 g∙mol-1
C 35,06 %, H 6,62 %, Br 58,32 %,Propriétés physiques T° fusion -112,4 °C[1] T° ébullition 102 °C[1] Solubilité presque insoluble dans l'eau (0,6 g/l), soluble dans l'éthanol, l'éther Masse volumique 1,2686 g∙cm-3 à 20 °C[2] T° d’auto-inflammation 265 °C[1] Point d’éclair 13 °C[1] Limites d’explosivité dans l’air 2,6 - 6,6 Vol.-%[1] Pression de vapeur saturante 43 mbar à 20 °C
68 mbar à 30 °C
175 mbar à 50 °C[1]Précautions Directive 67/548/EEC [1] 
Xi
F
NPhrases R : 11, 36/37/38, 51/53, Phrases S : 16, 26, 61, Transport 33 1126 NFPA 704 SIMDUT[3] 
Composés apparentés Isomère(s) 2-Bromobutane Autres composés 1-Chlorobutane
1-IodobutaneUnités du SI & CNTP, sauf indication contraire. Le 1-bromobutane (CH3CH2CH2CH2Br) est un dérivé halogéné du butane, ou l'un des atomes d'hydrogène (fixé sur un atome de carbone primaire) a été substitué par un atome de brome. C'est un halogénure d'alkyle primaire.
En conditions normales, il se présente sous la forme d'un liquide incolore, insoluble dans l'eau, mais soluble dans l'éthanol et l'éther.
Sommaire
Synthèse
Le 1-bromobutane peut être synthétisé par substitution nucléophile du butan-1-ol par l'acide bromique, le tribromure de phosphore ou encore le bromure de sodium.
Utilisations
En tant qu'halogénure d'alkyle primaire, le 1-bromobutane réagit spécifiquement par des réactions de type SN2. Il est couramment utilisé comme réactif pour des réactions d'alkylation, ou transformé en organomagnésien par réaction avec le magnésium dans l'éther pour former des liaisons carbone-carbone.
Le 1-Bromobutane peut aussi être utilisé pour synthétiser d'autre composés organométalliques, comme le n-butyl lithium:[4]
- 2 Li + C4H9Br → C4H9Li + LiBr
Le lithium utilisé pour cette réaction contient en général entre 1 et 3% de sodium. Lorsque le bromobutane est utilisé comme réactif, le produit final est une solution homogène, constituée de clusters mélant bromure de lithium (LiBr) et butyl lithium (LiBu).
Sécurité
Les vapeurs de 1-bromobutane peuvent former avec l'air un mélange explosif (point d'éclair 13 °C, température d'auto-inflammation 265 °C). Il convient donc de le conserver à l'abri de l'air.
Voir aussi
- Chlorobutane
- 2-bromobutane
Références
- ↑ a , b , c , d , e , f et g Entrée de « 1-Brombutane » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 25 mars 2009 (JavaScript nécessaire)
- ↑ fiche sur la CSST
- ↑ « Bromo-1 butane » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ (en) Brandsma, L.; Verkraijsse, H. D., Preparative Polar Organometallic Chemistry I, Springer-Verlag, Berlin, 1987 (ISBN 3-540-16916-4)
- (de) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en allemand intitulé « 1-Brombutan ».
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « 1-Bromobutane ».
Catégories : Composé du brome | Produit chimique irritant | Produit chimique facilement inflammable | Produit chimique dangereux pour l'environnement | Bromoalcane
Wikimedia Foundation. 2010.


