- Acide carbolique
-
Phénol (molécule)
 Pour les articles homonymes, voir Phénol.
Pour les articles homonymes, voir Phénol.Phénol 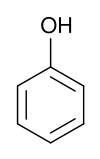
structure du phénol Général Nom IUPAC Phénol Synonymes Acide phénique
Acide carboliqueNo CAS No EINECS DrugBank FEMA SMILES InChI Apparence cristaux incolores à jaunes ou rose clair, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C6H6O [Isomères] Masse molaire 94,1112 g∙mol-1
C 76,57 %, H 6,43 %, O 17 %,pKa (pKaPhOH2+/PhOH) - 6.4
(pKaPhOH/PhO-) 9.95Propriétés physiques T° fusion 43 °C[1] T° ébullition 182 °C[1] Solubilité 9,8 g/100 ml d'eau Masse volumique 1.06 g/cm³[1] T° d’auto-inflammation 715 °C[1] Point d’éclair 79 °C (c.f.)[1] Limites d’explosivité dans l’air en volume % dans l'air : 1.36-10[1] Pression de vapeur saturante à 20 °C : 47 Pa[1] Précautions Directive 67/548/EEC 
T
CPhrases R : 23/24/25, 34, 48/20/21/22, 68, Phrases S : (1/2), 24/25, 26, 28, 36/37/39, 45, Transport[3] 60 1671
60 2312
60 2821 NFPA 704 SIMDUT[4] 

SGH[5] 


DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[2] Écotoxicologie LogP 1.46[1] Unités du SI & CNTP, sauf indication contraire. Le phénol, appelé aussi hydroxybenzène, acide phénique, ou encore acide carbolique, est composé d'un cycle aromatique benzènique (hydrocarbure aromatique) et d'une fonction hydroxyle. C'est la plus simple molécule de la famille des phénols.
Sommaire
Représentations
Origine
Découvert à l'état impur par Johann Rudolf Glauber en 1650 à partir de la distillation du goudron de houille. Il le décrit comme "une huile vive et rouge de sang qui assèche et guérit tous les ulcères humides". En 1834, Friedrich Ferdinand Runge parvient à l'isoler et le nomme alors acide carbolique. Il fut synthétisé et manufacturé en 1889 par la firme BASF.
Énol
Le phénol est aussi un énol (dérivé alcoolique possédant un fonction alcène). Il est la forme tautomère de la cyclohexa-2,4-diènone. Mais contrairement à la majorité des énols, il est la forme la plus stable comparé à sa cétone tautomère, stabilité due en majorité à la présence d'un cycle aromatique non présent dans la cétone correspondante.
Propriétés physiques
Le phénol a une constante molale cryoscopique de 6,84 °C∙kg/mol et une constante molale ébullioscopique de 3,54 °C∙kg/mol. De couleur blanche à l'état pur, il a tendance à s'oxyder légèrement au contact de l'air pour donner des traces de quinones qui le colorent en rose, puis en rouge
Production
- En 2005, le phénol a été produit à hauteur de 8 800 000 T dans le monde dont 26 % aux USA et 2 % en France. Le principal producteur est INEOS Phenol [6](Royaume Uni) avec une capacité de production de 1 600 000 T[7].
- Le phénol est produit aujourd'hui à plus de 85% par synthèse à partir du cumène. Ce procédé mis aux point en 1944 par Hock et Lang est utilisé depuis les années 1950. Son avantage réside dans sa simplicité de mise en oeuvre, son bon rendement (90%) et le fait d'obtenir phénol et acétone à partir du cumène disponible en grande quantité par pétrochimie. Il consiste en une oxydation du cumène par l'air fournissant l'hyperoxyde de cumyle en tant qu'intermédiaire qui en milieu acide aqueux fournit le phénol et l'acétone.
Utilisation
- Intermédiaire important pour de nombreuses synthèses de produits pharmaceutiques voir Phénol (groupe)
- En parfumerie: thymol, estragol,eugénol, vanilline etc ..
- En médecine, il est surtout utilisé comme antiseptique puissant.
- En biologie moléculaire, le phénol est utilisé pour éliminer les protéines dans les protocoles d'extraction d'acides nucléiques
- Préparation de la phénolphtaléine : un indicateur de pH bien connu des chimistes.
- Par action du chlore gazeux sur le phénol, on obtient des chlorophénols, tels le 2,4,6-trichlorophénol.
- Utilisé en entomologie pour la conservation des planches d'insectes contre les moisissures.
Sécurité
Le phénol est fortement corrosif pour les organismes vivants. Même une solution aqueuse à 1 % génèrera des irritations sévères.
Les brûlures au phénol sont très douloureuses et longues à guérir. De plus, elles peuvent être suivies de complications graves pouvant mener à la mort de par la toxicité de ce composé et sa capacité à pénétrer dans l'organisme en traversant la peau.
Voir aussi
- Pyrocatéchol, phénol substitué par un groupement hydroxyle en position ortho
- Résorcine, phénol substitué par un groupement hydroxyle en position méta
- Hydroquinone, phénol substitué par un groupement hydroxyle en position para
Notes et références
- ↑ a , b , c , d , e , f , g , h et i PHENOL, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ Entrée de « Phenol » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 25 août 2009 (JavaScript nécessaire)
- ↑ « Phénol » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ (en)Site institutionnel
- ↑ Données sur la production industrielle de phénol
- Portail de la chimie
- Portail de la pharmacie
Catégories : Produit chimique toxique | Produit chimique corrosif | Phénol | Antiseptique
Wikimedia Foundation. 2010.