- Complexe chimique
-
Complexe (chimie)
En chimie, plus particulièrement en chimie inorganique, un complexe est un édifice polyatomique constitué d'un cation ou de plusieurs (le plus souvent métallique) entouré de plusieurs ligands qui sont des molécules ou des ions qui délocalisent une partie de leur densité électronique sur le cation, formant ainsi des liaisons chimiques avec celui-ci. Les subdivisions de la chimie décrivant la formation, la structure et la réactivité de ces complexes sont la chimie organométallique (si le complexe comporte des liaisons métal-carbone) et la chimie de coordination (dans le cas contraire).
Voir également l'article sur les complexes en biologie.
Sommaire
Nomenclature
Noms des ligands
Les noms des ligands anioniques finissent toujours en "o"
Exemples:- F − : fluoro
- Cl − : chloro
- Br − : bromo
- I − : iodo
Les noms des ligands neutres ne sont pas modifiés, sauf pour :
- H2O: aqua
- NH3: ammine
- NO: nitrosyle
- CO: carbonyle
Le nombre de ligands est précisé par le préfixe: mono, di, tri, tétra, penta, hexa, etc...
Nom des Complexes formés
On écrit le nombre et la nature des ligands, la nature de l'ion (ou atome) central et entre parenthèses un chiffre romain qui précise le nombre d'oxydation du métal.
Si la charge du complexe est négative, on ajoute la terminaison "ate". Dans le cas contraire, on note le nom du métal.
Exemples:- [Ag(CN)2]-: ion dicyanoargentate (I)
- [Fe(H2O)6]2+ : ion hexaquafer(II)
- [Fe(SCN)]2+ : ion monothiocyanate de fer (III)
Les ligands
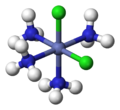
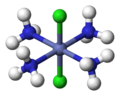
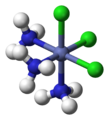
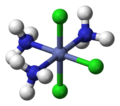
Structure géométrique des complexes
Nombre de coordination
La structure d'un complexe dépend de son nombre de coordination, égal au nombre de liaisons σ entre les ligands et l'atome central). Le nombre de coordination d'un ligand est compris entre 2 et 9, mais les complexes comprennent un grand nombre de ligands (supérieur à 6). Les nombres de coordination les plus fréquents sont 4 et 6. Le nombre de liaisons métal-ligand dépend de la taille, de la charge et de la configuration électronique de l'ion métallique. La plupart des ions peuvent accepter plusieurs nombres de coordination, adoptant alors des géométries différentes.
La chimie des complexes est dominée par les interactions entre les orbitales moléculaires s et p des ligands et les orbitales atomiques d (ou f) de l'ion central. Les orbitales s, p et d du métal peuvent accepter un total de 18 électrons (pour les éléments du bloc f, ce maximum augmente à 32 électrons). Le nombre de coordination maximal dépend donc de la configuration électronique du métal (plus particulièrement du nombre d'orbitales vacantes qui peuvent engendrer une liaison σ ligand-métal). Toutefois, contrairement à la règle de l'octet en chimie organique, la règle des 18 électrons n'est pas absolue et de nombreux complexes stables ne la respectent pas.
Le nombre de coordination d'un complexe dépend aussi de la taille des ligands et du cation métallique. De petits ligands autour d'un gros cation vont entraîner un faible encombrement stérique, ce qui conduit à de grands nombres de coordination.
Exemple : [Mo(CN)8]4-
De petits cations entourés de gros ligands vont avoir des nombres de coordination faibles.
Exemple : Pt[P(CMe3)3]2
Pour les métaux de transition de la série 3d, qui incluent les métaux d'intérêt biologique (et qui sont les plus abondants sur Terre) tels que le fer, le manganèse, le zinc, le cuivre... le nombre de coordination est habituellement compris entre 4 et 6. De par leur grande taille, les lanthanides, les actinides et les métaux de transition des séries 4d et 5d pourront avoir des nombres de coordination grands (> 6).
Différentes géométries possibles
L'arrangement spatial des ligands dépend du nombre de coordination (NC) du complexe.
Pour la plupart des structures, on place l'ion métallique au centre d'une sphère où sont placés les différents ligands (on considère alors la distance ion-ligand comme identique). Les recouvrements orbitalaires ligand-métal et les répulsions électrostatiques entre les ligands tendent à former des structures géométriques régulières. Les complexes métalliques respectent la théorie VSEPR sauf quand des facteurs électroniques fins (qui peuvent être liés à des distorsion dues à l'Effet Jahn-Teller), ce qui est le cas par exemple pour les complexes de Cu(II) et de Ni(III) qui sont souvent en géométrie octaédrique avec une distorsion tétragonale (2 liaisons dans un axe plus longues ou plus courtes que les 4 autres) ou plan carrée (distorsion tétragonale poussée à l'infini), qui ne sont pas des géométries canoniques prédites par la théorie VSEPR. L'encombrement stérique dû à la coordination de ligands encombrés peut aussi modifier la géométrie des complexes.
- On a regroupé ci-dessous la liste des structures les plus répandues en fonction du nombre de coordination (NC) (ou coordinence) :
- NC = 2 : linéaire,
- NC = 3 : trigonale plane,
- NC = 4 : tétraédrique ou plan carrée
- NC = 5 : bipyramidale à base triangulaire ou pyramidale à base carrée
- NC = 6 : octaédrique ou prisme trigonale
- NC = 7 : bipyramidale à base pentagonale
Dans de nombreux cas, la géométrie réelle s'écarte de la structure théorique. Par exemple, le complexe peut comporter des ligands différents (les longueurs des liaisons ion-ligand ne sont plus identiques, et la structure n'est plus celle d'un polyèdre régulier). La taille des ligands peut modifier la structure du complexe de part une pressions stérique trop importante. Aussi dans le cas de complexes avec des polydentes, la structure des molécules portant les doublets électroniques assurant la coordination au métal peut être incompatible avec les exigences géométriques de la coordination (il en résulte des complexes distordus).
Isomérie
Isomérie Géométrique
L'isomérie géométrique a lieu dans les complexes octaédriques et carrés plans mais pas dans les complexes tétraédriques. Quand, dans de tels complexes, des ligands sont dans des positions adjacentes, on utilise le descripteur cis, et quand ils sont dans des positions opposées, le descripteur trans
Quand trois ligands identiques ou les trois fonctions coordonnantes d'un ligand tridente occupent une face d'octaèdre, on parle d'isomère facial (fac), s'ils occupent une arête de l'octèdre, on parle d'isomère méridional (mer).
Isomérie Optique
L'isomérie optique a lieu lorsque l'image d'une molécule dans un miroir n'est pas superposable avec la molécule originale. Des échantillons pur d'isomères optiques font tourner le plan de polarisation de la lumière polarisée. Les composés dans le tableau suivant sont des exemples de paires d'isomères optiques en chimie de coordination.
Réactions de complexation
D’une façon générale, la formation d’un complexe à partir d’un métal M et de n ligand L s’écrira :
Mt+ + nLu-⇆ [M(L)n]t-nu+
À cette réaction est associée une constante d’équilibre K:
- Kf: constante de formation qui s'écrit
![K_f = {[M(L)_n] \over [M][L]^n }](/pictures/frwiki/50/2f02c3ae0a877a2866c4fe780eb64671.png)
- Kd: constante de dissociation qui s'écrit
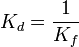
Ces constantes s'expriment de façon approximative en faisant apparaitre les concentrations au lieu des activités des ions (ou molécules) présents à l'équilibre, on n'y fait jamais apparaitre les solides et le solvant(le plus souvent de l'eau) Au Kd, on associe un pKd = − log(Kd).
Plus le pKd est petit moins le complexe est stable.Exemple: Ag+ + 2NH3 ⇆ [Ag(NH3)2]+
![K_f = {[Ag(NH_3)_2]^+ \over [Ag^{+}][NH_3]^2 }](/pictures/frwiki/49/14e883310af167b4518fe88225bb51fb.png)
Applications des complexes
Les complexes métalliques ont une importance capitale en chimie et interviennent dans beaucoup de domaines d'avant-garde.
Les complexes métalliques en catalyse
La configuration des ligands autour d'un centre métallique, la possibilité d'échanger des ligands et la capacité de certains métaux à s'insérer dans des liaisons covalentes (en particulier les liaisons multiples) de façon réversible rend les complexes métalliques extrêmement utiles en catalyse. En effet, la coordination à un centre métallique abaisse l'énergie d'activation de réaction par formation d'un ou plusieurs complexes intermédiaires et influe sur la sélectivité de la réaction. Dans la nature, il y a aussi des complexes métalliques qui interviennent dans les métalloprotéines (fer dans l'hémoglobine, magnésium dans la chlorophylle, cuivre dans l'hémocyanine...). Ces complexes sont un des objets d'étude de la chimie bioinorganique.
Les complexes en chimie des solutions
Les complexes en chimie des solutions ont des utilités multiples:
- Solubiliser un métal contenu dans un minerai (Exemple : l'or solubilisé comme un complexe cyanuré)
- Caractériser la présence d'une espèce chimique par formation d'un complexe coloré.
En médecine
- Des complexes de platine sont utilisés dans le traitement de certains cancers (cisplatine, carboplatine, oxaliplatine…).
- La capacité complexante de l'EDTA est mise à profit dans le traitement d'intoxication par des métaux, le plomb en particulier.
- Des complexes de gadolinium sont utilisés comme agents de contraste en imagerie par résonance magnétique (IRM).
Autres utilisations
- Le complexe Fe(CO)5 liquide à température ambiante permet d'obtenir par distillation du fer très pur.
Notes et références
Voir aussi
Articles connexes
- Portail de la chimie
Catégories : Composé chimique | Chimie des solutions | Chimie inorganique
Wikimedia Foundation. 2010.