- Chaetognatha
-
 Chætognathes
Chætognathes
Cliché MEB de Sagitta sp. Classification Règne Animalia Sous-règne Eumetazoa Infra-règne Bilateria Division Protostomia Embranchement Chætognatha
Leuckart, 1854Familles de rang inférieur Tokioka (1965) revu Papillon (2006). - classe Sagittoidea
- ordre Phragmophora
- famille Eukrohniidae
- incluant genre Heterokrohnia
- famille Spadellidae
- incluant genre Pterosagitta
- famille Eukrohniidae
- ordre Aphragmophora
- famille Krohnittidae
- famille Sagittidae
- ordre Phragmophora
Classification phylogénétique Position :
Les Chætognathes (Chætognatha, orthographe francisée « chétognathes ») sont un embranchement (phylum) de prédateurs marins. Leur nom, du grec khaitē (« chevelure ») et gnathos (« mâchoire »), provient des crochets mobiles qui permettent la capture de leurs proies. Ils sont parfois appelés « vers sagittaires » en raison de leur forme de flèche. Le positionnement des Chætognathes au sein de l'arbre des animaux a été l'objet d'un longue controverse mais des arguments sérieux permettent dorénavant de les classer au sein des protostomiens, l'une des deux grandes lignées d'animaux bilatériens avec les deutérostomiens. Les Chætognathes forment un groupe animal très ancien comme l'attestent plusieurs fossiles datant du cambrien inférieur. Ils jouent un rôle majeur dans l'écosystème planctonique comme principaux prédateurs directs des copépodes et représentent jusqu'à 10% de la biomasse du zooplancton.
Les Chætognathes apparaissent pour la première fois dans des dessins du naturaliste hollandais Martinus Slabber en 1775[1]. Actuellement, le phylum est composé d’une trentaine de genres et d’environ 150 espèces dont la taille peut varier de 2 mm à 12 cm environ. On les trouve dans tous les habitats marins, des zones côtières au benthos océanique[2].
Sommaire
Paléontologie
Les Chætognathes constituent un des plus anciens embranchements. Des Chætognathes fossiles ont été retrouvés dans des gisements célèbres du cambrien tels que le schiste de Burgess ou le gisement de Chengjiang. De nombreux spécimens ont été successivement proposés comme étant le plus ancien Chætognathe. Parmi les spécimens récemment décrits, on trouve :
- Amiskwia découvert par Walcott dans la célèbre faune de Burgess a généralement été considéré comme un Chætognathe mais cette hypothèse fut rejetée par la suite.
- Paucijaculum décrit par Schram en 1973 est plus tardif (carbonifère) et a constitué pendant une longue période le fossile le plus ancien.
- Eognathacantha ercainella a été décrit en 2002 par Chen et Wuang comme un Chætognathe du cambrien inférieur (520 Ma) malgré une assez faible qualité de préservation[3].
- les protoconodontes, microfossiles du Cambrien ont été proposés comme des crochets fossilisés par Szaniawski sur la base d'une analyse comparative assez détaillée[4].
- Oesia disjuncta constitue un retour à l'origine du débat car ce fossile du schiste de Burgess originellement décrit par Walcott est interprété en 2005 par Szaniawski comme un Chætognathe[5].
- Protosagitta spinosa cité au départ par Chen et Wuang a fait l'objet d'une récente analyse détaillée fondée sur l'analyse de certaines structures fines particulièrement bien conservée dans de nouveaux spécimens. Ce fossile du gisement de Chengjiang (cambrien inférieur) constitue donc le fossile le plus ancien et le mieux décrit à ce jour[6].
Ainsi, non seulement le phylum des Chætognathes est contemporain de l'explosion cambrienne mais il possédait dès cette époque une morphologie quasiment identique à celle qu'il présente aujourd'hui. Ce cas de conservation morphologique est très surprenant et relativement rare, mais suggère également que le mode de vie des Chætognathes est resté inchangé depuis le Cambrien.
Reproduction et développement
Les Chætognathes sont hermaphrodites et leur reproduction se fait par fécondation croisée. Le développement est direct, sans mue ni étape larvaire. L’œuf, transparent, subit une segmentation radiaire totale et égale. Cependant, des expériences de marquage des premiers blastomères ont montré que la disposition tétraédrale des blastomères au stade quatre cellules correspondait aux futurs axes corporels, une caractéristique également présente chez les spiraliens[7].
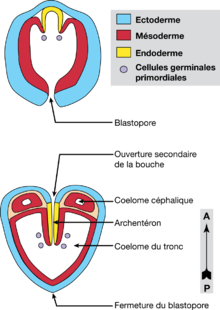
Une blastula avec un blastocœle étroit se développe. Au stade de 64 cellules, le déterminant des lignées germinal, un corps rond et petit formé après la fécondation près du pôle végétal, se divise pour la première fois et est distribué dans deux blastomères, les futures cellules germinales primordiales (CGP)[8]. Au stade suivant, une invagination typique forme la gastrula. Deux invaginations antéro-latérales de l’endoderme forment ensuite deux plis qui migrent vers le blastopore directement à l’intérieur de l’archentéron. Ces plis poussent à leur pointe les CGP qui se divisent à nouveau. Il s’agit là d’une forme particulière d’entérocœlie dans laquelle le mésoderme se forme par des plis qui migrent à l’intérieur de l’archentéron, plutôt que par la formation de poches qui envahissent le blastocœle.
Dans la région antérieure de l’embryon se forment donc l’intestin, les sacs mésodermaux bilatéraux (futur cœlome) et une invagination stomodeale ventrale, alors que le blastopore, situé à l’opposé, se ferme. La différenciation des régions ectodermales occupées par le système nerveux adulte est très précoce, le ganglion ventral apparaissant sous la forme de deux masses cellulaires bilatérales. Les cœlomes primaires de la tête et du tronc s’individualisent puis l’embryon s’allonge et se courbe progressivement à l’intérieur de l’œuf. Toutes les cavités se réduisent ensuite considérablement. Au cours cet allongement A/P, l’ensemble du système nerveux poursuit sa différenciation et on peut alors observer au niveau du ganglion ventral la mise en place de la neuropile (axones) et le futur ganglion cérébroïde dans la tête. Enfin, précédant l’éclosion, la différenciation des muscles longitudinaux débute dans le mésoderme du tronc.
Après l’éclosion, le mésoderme du nouveau-né apparaît comme une masse cellulaire indifférenciée dans laquelle il est impossible de repérer les futurs territoires tissulaires de l’adulte. La formation des épithéliums lignant la cavité générale du tronc se déroule durant les deux premiers jours de développement du nouveau-né. L’apparition progressive de ces tissus conduit à la ségrégation finale des lignées germinales (formation du septum caudal à partir de cellules péritonéales spécialisées séparant les ovaires situées antérieurement des testicules situées postérieurement) et à la mise en place du plan d’organisation adulte : division du corps en trois régions, réouverture des cavités générales, ouverture du tube digestif et différenciation des structures céphaliques.
Systématique du phylum
Le caractère clef de la systématique du phylum est la présence ou non de musculature transverse (les phragmes). Ce caractère permet de subdiviser les six genres décrits en deux ordres : Phragmophora (présence de phragmes) et Aphragmophora (absence de phragme). Cette subdivision a été confirmée par des analyses de phylogénie moléculaire réalisées à partir de l'ARN le gène de la grande sous unité de l'ARN ribosomique 28S[9] et par la suite de la petit sous unité l'ARNr 18S[10]. Cette phylogénie est en accord avec les principaux caractères morphologiques tels que le nombre et la structure des nageoires, le type de fibres musculaires ou le rapport tête/corps. Cependant, la phylogénie moléculaire a mis en lumière la limite des caractères traditionnels : l'espèce planctonique Pterosagitta draco dépourvue de musculature transverse (phragmes), auparavant classée dans l’ordre des aphragmophora, a été incluse dans l’ordre des phragmophora. Cette perte des phragme chez Pterosagitta draco peut être expliquée le changement de milieu de vie : ce membre de la famille benthique des spadellidae se serait adapté à la vie planctonique.
Position phylogénétique du phylum
Une morphologie controversée
Les Chætognathes partagent des caractères traditionnellement attribués aux deutérostomiens et aux protostomiens. Malgré une morphologie rappelant celle des protostomiens, la position phylogénétique traditionnelle des Chætognathes a longtemps été celle avancée par Hyman (1959) qui les considérait comme des parents éloignés des deutérostomiens en raison de leurs caractères embryologiques (voir aussi Willmer, 1990). Cependant, considérant équitablement les caractères embryologiques et morphologiques, Beklemishev (1969) conclut que les Chætognathes demeuraient parmi les phyla les plus isolés du monde animal et les a placés, avec les brachiopodes, hors des deutérostomiens et des protostomiens. Une position retrouvée dans le système du vivant proposé par Cavalier-Smith (1998), où les Chætognathes sont les seuls membres des Chætognathi, une des quatre divisions majeures des protostomiens (avec les Lophozoa, Platyzoa et Ecdysozoa). Meglitsch et Schram (1991), suivis par Eernisse et al. (1992), ont placé les Chætognathes parmi les aschelminthes, suite à leur étude cladistique de matrices de caractères morphologiques. Nielsen (2001) a considéré les Chætognathes comme le groupe frère des gnathostomulides et des rotifères, au sein des Gnathifera, sur la base des crochets chitineux entourant la bouche et de l'innervation des muscles du ganglion vestibulaire. L’hermaphrodisme obligatoire avec la présence des gonades femelles en position antérieure par rapport aux gonades mâles a aussi été un caractère proposé pour rapprocher les Chætognathes et les gnathostomulides (Zrzavy, 1993).
Premières analyses de phylogénie moléculaire
C'est en 1993 que, pour la première fois, l'outil moléculaire a été utilisé pour préciser la position phylogénétique des Chætognathes. À partir de l'analyse du 18S de l'espèce Sagitta elegans, Telford et Holland ont suggèré que les Chætognathes auraient divergé précocement au sein des bilatériens, en même temps que les platyhelminthes. Ce résultat a été dans un premier temps conservé au cours des années suivantes avec l'inclusion à la fois de nouvelles espèces de Chætognathes et de nouveaux phyla tels que les nématodes, les gnatostomulides ou les nématomorphes. Cependant, le rapprochement des Chætognathes avec les platyhelminthes ou les nématodes décrit par l'ensemble de ces travaux pourrait être expliqué par un phénomène d'attraction des longues branches causé par les taux d'évolution très rapides observés pour l'ARN 18S dans ces différents groupes. Des problèmes similaires ont été rencontrés avec l'ARN 28S (LSU) ce qui confirme la difficulté de l'analyse moléculaire pour le phylum des Chætognathes.
Un certain nombre d'arguments complémentaires mais jamais définitifs se sont par la suite accumulés comme des analyses fondées sur les filaments intermédiaires, l'analyse combinée de matrices morphologiques[11] et même la recherche d’un marqueur tissulaire spécifique (Haase et al. 2001). L'ensemble de ces études proposent différentes positions comme une position isolée au sein des bilatériens, une inclusion dans les deux clades connus de protostomiens : les lophotrochozoaires et les ecdysozoaires, une exclusion des ecdysozaires mais aucune d'entre elles ne suggère le rapprochement historique des Chætognathes avec les deutérostomiens.
Pour conclure sur cet aperçu de la controverse autour de la position phylogénétique des Chætognathes, force est de constater que la situation n’a pas beaucoup évolué depuis Darwin (1844), qui considéraient les Chætognathes comme « remarquables pour l’obscurité […] de leurs affinités ». Dans les ouvrages de Lecointre et Le Guyader (2001) et de Nielsen (2001), comme dans d’autres travaux, les Chætognathes appartiennent aux protostomiens, mais toujours avec une pointe d’incertitude, due notamment à l’absence de données moléculaires fiables.
Génomes mitochondriaux
Le séquençage de génomes mitochondriaux de Chætognathe a permis d'apporter de nouveaux arguments moléculaires basés sur l'analyse de l'alignement des séquences des gènes ou de la structure du génome mitochondrial.
Le génome mitochondrial de S. cephaloptera s’est révélé être très particulier, à la fois par sa taille et sa composition. Avec 11905 pb, il est le plus petit génome mitochondrial de métazoaire connu et contient seulement 13 des 37 gènes habituels. Le plus surprenant a été l’incapacité d’isoler le moindre ARN de transfert (ARNt) mitochondrial parmi les 22 habituellement présents dans les génomes mitochondriaux d’animaux. Parmi les treize gènes usuels codant des protéines, les gènes atp6 et atp8 sont absents. En dépit de cette organisation très peu commune, les diverses analyses des séquences de protéines mitochondriales révèlent des zones qui constituent clairement une signature de protostomiens. Il n'y a aucune jonction de gènes en commun avec les deutérostomiens dans le génome mitochondrial de S. cephaloptera. Cependant, aucune de ces données ne permet de déterminer des affinités plus précises à l’intérieur du groupe protostomien.
Exactement deux jours avant que l'article traitant du génome mitochondrial de S. cephaloptera ne soit accepté par Molecular Biology and Evolution, l’article de Helfenbein et al. (2004), sur le génome mitochondrial de Paraspadella gotoi était publié dans PNAS. Soulignant l’importance de ces travaux pour le décryptage de la phylogénie animale, Telford (2004b) a publié un commentaire couvrant les deux articles dans la partie ‘News and Views’ de la revue Nature. Il y a donc ainsi deux génomes complets de Chætognathes aujourd’hui disponibles. Les résultats des deux équipes sont équivalents : le génome mitochondrial de P. gotoi est très réduit (11424 pb), et son étude montre que les Chætognathes sont des protostomiens. Parmi les différences avec le génome de S. cephaloptera, on peut citer la présence d’un unique ARNt, celui de la méthionine (trnM) ou le fait que le génome comprend deux ensembles de gènes, chacun transcrit dans un sens différent. L’analyse phylogénétique des séquences du génome mitochondrial de P. gotoi montre que les Chætognathes sont le groupe frère des protostomiens, du moins, précisent les auteurs, des protostomiens échantillonnés dans l’étude. Les analyses phylogénétiques des deux génomes présentent plusieurs différences, susceptibles d'expliquer les légères différences de résultat :
- Helfenbein et al. (2004) n’ont utilisé que huit séquences de protéines mitochondriales (cob, cox1, 2, 3, nad1, 3, 4 et 5) alors que les onze protéines du génome de S. cephaloptera (nad2, 4L et 6 en séquences supplémentaires) ont été utilisées.
- L'échantillonnage taxonomique est sensiblement différent
- L’analyse phylogénétique des séquences primaires de P. gotoi n’a été faite qu’avec la méthode de parcimonie.
Phylogénomique
Chez Spadella cephaloptera 11 526 ESTs ont été séquencés par le Génoscope (Evry, Paris). À partir de ces séquences, un jeu de données de 79 protéines ribosomales concaténées chez 18 taxa, représentant plus de 11 500 positions, a été analysé. Une nouvelles fois, les Chætognathes se trouvent liés aux protostomiens, confirmant les résultats issus du marqueur mitochondrial, et en position basale[12]. Un projet similaire, avec Flaccisagitta enflata, a abouti à une conclusion similaire (affinité des Chætognathes avec les protostomiens) mais avec une position différente à l’intérieur des protostomiens : à la base des lophotrochozoaires[13].
Implications de la position phylogénétique des Chætognathes
La division phylogénétique des bilatériens en protostomiens et deutérostomiens est traditionnellement basée sur les caractères suivants : l'origine du cœlome, la destinée du blastopore ou la segmentation de l’œuf. Le partage de certains de ces caractères entre les Chætognathes et les deutérostomiens (entérocœlie, deutérostomie, trimérisme, clivage radiaire ; Table 1), ainsi que l’absence de certaines caractéristiques (1) moléculaires (gènes hox, marqueur tissulaire ; voir plus bas pour les gènes hox de Chætognathes, Haase et al. 2001) ou (2) morphologiques (principalement la mue, la présence de lophophores ou de larves trochophores ; Lecointre et Leguyader 2001) définissant les ecdysozoaires et les lophotrochozoaires, soutiennent la position des Chætognathes à la base des protostomiens, à l’image de notre analyse phylogénomique (Fig. 3). Ainsi, les caractères de type deutérostomien auraient été conservés entre les Chætognathes et les deutérostomiens et perdus dans la lignée menant au dernier ancêtre commun des ecdysozoaires et des lophotrochozoaires.
Pourtant, le mode de formation du cœlome, la destinée du blastopore, ou le mode de clivage de l’œuf sont des caractères sujets à controverse, et ce depuis plusieurs décennies (Lovtrup 1975, Bergström 1986, Nielsen 2001). Pour exemple :
- les cas de deutérostomie peuvant être observés chez des annélides ou des mollusques (Lovtrup 1975, Arendt et Nubler jung 1997),
- les brachiopodes ou les entéropneustes comprenant à la fois des organismes schizocœliens et entérocœliens,
- ou encore le cœlome des tardigrades se formant par entérocœlie (Bergström 1986, Nielsen 2001, Jenner 2004).
Enfin, les Chætognathes ne sont, en réalité, pas des animaux trimériques, mais dimériques. L’observation des étapes précoces de l’embryologie montre que la différenciation du mésoderme conduit à la formation de seulement deux paires de sacs cœlomiques : le cœlome primaire céphalique et le cœlome primaire du tronc (Doncaster 1902).
Ce bref rappel montre que les critères ontologiques qui définissent traditionnellement les lignées deutérostomiennes et protostomiennes peuvent être trompeurs. Et c’est la prise en compte de la diversité animale dans son ensemble qui nous permettra de ne pas surestimer la conservation de caractères en réalité très labile et de mieux appréhender l’évolution et ces mécanismes. À ce titre, les phylums mineurs encore peu étudiés, comme les Chætognathes, ont toute leur importance.
Evodevo
Les gènes hox codent des facteurs de transcription à homéodomaine. Ils sont impliqués dans la régionalisation de l’axe antéropostérieur des animaux et ont été découverts chez la drosophile mais ont ensuite été caractérisés chez tous les bilatériens, ainsi que chez les cnidaires[14].
Chez Spadella cephaloptera, plusieurs gènes hox ont été identifiés : un membre du groupe de paralogie hox3 (sceHox3), quatre gènes médians (sceMed1-4) et un gène mosaïque qui partage des caractéristiques à la fois avec les classes de gènes médians et postérieurs (sceMedPost). Aucun des gènes hox spécifiques de Lophotrochozoaires, d’Ecdysozoaires ou de deutérostomiens n’a pu être clairement identifié. Plusieurs hypothèses ont été envisagées pour expliquer la présence de SceMedPost, mais la position phylogénétique issue des analyses de l’ADN mitochondrial et des protéines ribosomales suggèrerait plutôt qu’il s’agit d’un gène dérivé spécifique du phylum.
L’expression d’un de ces gènes, sceMed4, a été étudiée à diverses étapes du développement de S. cephaloptera, où il est exprimé dans deux massifs cellulaires latéraux au niveau du tronc. Cette région d’expression est localisée dans les corps cellulaires neuronaux du ganglion ventral en formation. Aucune expression n’est détectée dans le reste du système nerveux (ganglion cérébroïdes et neuropile ventrale). Ces résultats préliminaires représentent les premières données d’expression d’un gène hox chez les Chætognathes, suggérant un rôle de SceMed4 dans la régionalisation du système nerveux central, une fonction qu’assurent les gènes hox chez un grand nombre de bilatériens.
Références
- Blogpost à propos de Martinus Slabber and Dessins originaux sur le site du MBL de Woods Hole incluant le fameux dessin montrant un Chætognathe
- The Biology of Chætognaths (1991) Q. Bone, H. Kapp, and A.C. Pierrot-Bults, eds., Oxford University Press
- Chen JY and Huang DY (2002) A Possible Lower Cambrian Chætognath (Arrow Worm). Science 298: 187.
- Szaniawski H (2002) New evidence for the protoconodont origin of Chætognaths. Acta Palaeontologica Polonica 47: 405–419.
- Szaniawski H. (2005) Cambrian Chætognaths recognized in Burgess Shale fossils. Acta Pal. Polonica 50, 1–8.
- Vannier J, Steiner M, Renvoisé E, Hu, SX, Casanova JP (2007) Proc. R. Soc. B 274, 627–633 doi:10.1098/rspb.2006.3761
- Shimotori T and Goto T (1999) Establishment of axial properties in the arrow worm embryo Paraspadella gotoi(Chætognatha): Developmental fate of the first two blastomeres, Zoological Science 16:459-469 Shimotori T and Goto T (2001) Developmental fate of the first four blastomeres of the Chætognath Paraspadella gotoi: Relationships to protostomes, Develop. Growth Differ 43:371-382
- Carré D., Djediat C. and Sardet C. (2002) Formation of a large Vasa-positive germ granule and its inheritance by germ cells in the enigmatic Chætognaths, Development 129:661-670
- Telford MJ, Holland PW (1997) Evolution of 28S ribosomal DNA in Chætognaths: duplicate genes and molecular phylogeny.44(2):135-44. doi:10.1007/PL00006130
- Papillon D, Perez Y, Caubit X, Le Parco Y (2006) Systematics of Chætognatha under the light of molecular data, using duplicated ribosomal 18S DNA sequences. Mol Phylogenet Evol. 38(3):621-34. doi:10.1016/j.ympev.2005.12.004
- Giribet et al. (2000), Peterson et Eernisse (2001)
- Marletaz, F., Martin, E., Perez, Y., Papillon, D., Caubit, X., Lowe, C.J., Freeman, B., Fasano, L., Dossat, C., Wincker, P., Weissenbach, J., and Le Parco, Y. (2006). Chætognath phylogenomics: a protostome with deuterostome-like development. Current Biology 16, R577-578.
- D. Matus, R. Copley, C. Dunn, A. Hejnol, H. Eccleston, K. Halanych, M. Martindale, M. Telford, (2006) Broad taxon and gene sampling indicate that Chætognaths are protostomes. Current Biology, Volume 16, Issue 15, Pages R575-R576
- Carroll et al. 2005
Voir aussi
Liens externes
- classe Sagittoidea
Wikimedia Foundation. 2010.