- 75-52-5
-
Nitrométhane
Nitrométhane 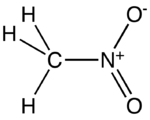
Général Nom IUPAC Nitrométhane No CAS No EINECS Apparence liquide visqueux incolore, d'odeur caractéristique.[1] Propriétés chimiques Formule brute CH3NO2 [Isomères] Masse molaire 61,04 g∙mol-1
C 19,68 %, H 4,95 %, N 22,95 %, O 52,42 %,Propriétés physiques T° fusion -29 °C[1] T° ébullition 101 °C[1] Masse volumique (eau = 1) : 1.14[1],
2.11 (vapeur)T° d’auto-inflammation 417 °C[1] Point d’éclair 35 °C c.f.[1] Limites d’explosivité dans l’air en volume % dans l'air : 7.3-60[1] Point critique 588 K (315 °C); 5,9MPa Point triple 244,77 K (-28,38 °C) Thermochimie ΔfH0gaz -81 kJ/mol ΔfH0liquide -113 kJ/mol Cp 106 J/mol.K (liquide) Chaleur latente
de vaporisation34 kJ/mol Chaleur latente
de fusion9,7 kJ/mol Précautions Directive 67/548/EEC 
XnPhrases R : 5, 10, 22, Phrases S : (2), 41, Transport - 1261 NFPA 704 SGH[3] 

AttentionClassification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[2] Unités du SI & CNTP, sauf indication contraire. Le nitrométhane est un composé organique dont la formule chimique est CH3NO2. Il est le plus simple composé organique nitré. Il s'agit d'un liquide visqueux, hautement polaire habituellement utilisé comme solvant dans les applications industrielles, comme les extractions, en tant que réactif ou solvant de nettoyage. En tant qu'intermédiaire dans la synthèse organique, il est très utilisé dans la fabrication de produits pharmaceutiques, pesticides, explosifs et fibres. Il est également utilisé comme carburant à haut potentiel pour les véhicules de course.
Sommaire
Préparation
Le nitrométhane peut être synthétisé par réaction du chloroacétate de sodium avec le nitrite de sodium en solution aqueuse :
- ClCH2COONa + NaNO2 + H2O → CH3NO2 + NaCl + NaHCO3
Il est extrait du mélange réactionnel par distillation.
À l'échelle industrielle, il est produit par nitration du méthane en faisant réagir en phase vapeur le méthane et l'acide nitrique.
Applications
Le nitrométhane est un solvant couramment utilisé en chimie organique[4].
Carburant
Le nitrométhane est utilisé comme carburant pour les véhicules de course, en particulier pour les dragsters, afin de fournir plus de puissance[5]. Il est également utilisé comme carburant, pour les mêmes raisons dans les moteurs thermiques de voitures et avions radiocommandés. Dans ces deux cas, il est souvent simplement surnommé nitro.
L'oxygène contenu par le nitrométhane lui permet de brûler avec beaucoup moins d'apport d'oxygène atmosphérique que d'autres hydrocarbures, comme l'essence par exemple. La réaction de combustion est la suivante :
- 4CH3NO2 + 3O2 → 4CO2 + 6H2O + 2N2
14,6 kg d'air sont requis pour la combustion d'un kg d'essence, mais seulement 1,7 kg sont requis pour un kg de nitrométhane. Comme le cylindre d'un moteur ne peut contenir qu'une quantité limitée d'air à chaque cycle, on peut donc brûler 8,7 fois plus de nitrométhane que d'essence. Cependant, le nitrométhane a une densité énergétique inférieure à celle de l'essence (11.3 MJ/kg pour le nitrométhane contre 42 à 44 MJ/kg pour l'essence. Ceci permet de déduire que le nitrométhane génère environ 2,3 fois plus d'énergie que l'essence lorsqu'il est combiné avec un volume d'oxygène donné.
Le nitrométhane peut aussi être utilisé comme monergol, car il peut se décomposer suivant la réaction :
- 4CH3NO2 → 4CO + 4H2O + 2H2 + 2N2
Notes et références
- ↑ a , b , c , d , e , f et g NITROMETHANE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Coetzee, J. F. and Chang, T. H., « Recommended Methods for the Purification of Solvents and Tests for Impurities: Nitromethane », dans International Union of Pure and Applied Chemistry, vol. 58, 1986, p. 1541-1545 [texte intégral]
- ↑ K. Owen and T. Coley, Automotive Fuels Reference Book - 2nd edition, Chapter 13 "Racing Fuels", (ISBN 1-56091-589-7) (1995)
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Nitromethane ».
Liens externes
- (fr) Fiche toxicologique de l'INRS
- (en) Fiche Nitrométhane sur le WebBook de chimie du NIST
- Portail de la chimie
- Portail des transports
Catégories : Produit chimique nocif | Solvant | Nitro | Carburant | Explosif
Wikimedia Foundation. 2010.

