- 74-84-0
-
Éthane
Éthane 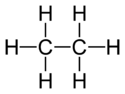
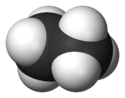
Représentations de l'éthane Général Nom IUPAC éthane Synonymes diméthyle
méthylméthane
biméthyleNo CAS No EINECS PubChem SMILES InChI Apparence gaz comprimé liquefié, incolore, inodore à l'etat pur[1]. Propriétés chimiques Formule brute C2H6 [Isomères] Masse molaire 30,069 g∙mol-1
C 79,89 %, H 20,11 %,Propriétés physiques T° fusion -183,3 °C[2] T° ébullition -88,6 °C[2] Solubilité dans l'eau à 20 °C : 4.7 ml/100 ml[1] Masse volumique 1,3551 kg⋅m-3 (0 °C, 1013 mbar, gaz)
0,5441 kg⋅l-1 (-88,6 °C, 1013 mbar, liquide)[2]T° d’auto-inflammation 515 °C[2] Point d’éclair -135 °C[2] Limites d’explosivité dans l’air 2,4 - 14,3 Vol.%
31-182 g/m³[2]Pression de vapeur saturante 37,8 bar à 20 °C
46,9 bar à 30 °C[2]Thermochimie S0liquide, 1 bar 126,7 J∙mol-1∙K-1[3] ΔfH0gaz -84,0 kJ∙mol-1[3] ΔfusH° 0,583 kJ∙mol-1 à -182,8 °C[3] ΔvapH° 9,76 kJ∙mol-1 à 25 °C
14,703 kJ∙mol-1 à -89 °C[3]Cp 52,49 J∙mol-1∙K-1 (25 °C, gaz)
68,68 J∙mol-1∙K-1 (-173,1 °C, liquide)[3]PCI -1 560,7 kJ∙mol-1[3] Précautions Directive 67/548/EEC[4] 
F+Phrases R : 12, Phrases S : 2, 9, 16, 33, Transport 23 1035
223 1961 NFPA 704 SIMDUT[5] 

SGH[6] 

DangerÉcotoxicologie LogP 1.81[1] Unités du SI & CNTP, sauf indication contraire. L'éthane est un un hydrocarbure de la famille des alcanes de formule brute C2H6. C'est un gaz combustible, incolore et inodore que l'on peut trouver dans le gaz naturel et aussi dans les gaz du pétrole.
Sommaire
Utilisation
L'éthane est le réactif de base pour la synthèse de l'éthylène via le vapocraquage, de monochloro-, du 1,1-dichloro-, et du 1,1,1-trichloroéthane par chloration. En combinant la chloration avec l'oxychloration, le chlorure de vinyle peut être synthétisé et la réaction de l'éthane avec l'acide nitrique en phase gazeuse permet la formation du nitrométhane et du nitroéthane[7].
L'éthane est un constituant du gaz de pétrole liquéfié qui est un combustible utilisé comme remplaçant du gaz naturel pour des applications particulières.
Propriétés physico-chimiques
L'éthane se décompose à partir d'une température de 500 °C. Sa solubilité dans l'eau et dans l'alcool est meilleure que celle du méthane puisque, à 20 °C, celle-ci est de 4,7 cm3 pour 100 cm3 d'eau et de 150 cm3 pour 100 cm3 d'alcool.
Production et synthèse
L'éthane est principalement issu de la purification du gaz naturel ou extrait du gaz de pétrole liquéfié, une fraction du pétrole[7].
Ecologie
Sur Terre, on mesure quinze mégatonnes de ce gaz dans l'atmosphère par an :
- deux à quatre mégatonnes sont libérées par les volcans de boue, sources géothermales, bassins pétroliers et microfuites de gaz au fond des océans ;
- une dizaine de mégatonnes proviennent des feux de forêt, de l’activitié biologique des océans, de la faune et des êtres humains[8].
Notes et références
- ↑ a , b et c ETHANE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b , c , d , e , f et g Entrée de « Ethane » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 19 avril 2009 (JavaScript nécessaire)
- ↑ a , b , c , d , e et f Ethane sur http://www.nist.gov/. Consulté le 19 avril 2009
- ↑ « éthane » sur ESIS, consulté le 15 février 2009
- ↑ « Éthane » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ a et b Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke, Ullmann's Encyclopedia of Industrial Chemistry, Hydrocarbons, Wiley-VCH Verlag GmbH & Co, 2000
- ↑ Sciences & Vie, On sait ce que la Terre dégaze d’hydrocarbures, nº 1098, mars 2009, p. 34.
Voir aussi
- Portail de l’énergie
- Portail de la chimie
Catégories : Produit chimique extrêmement inflammable | Alcane linéaire | Gaz organique | Réfrigérant
Wikimedia Foundation. 2010.


