- 69-72-7
-
Acide salicylique
Acide salicylique 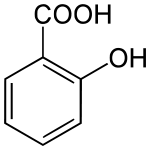
Général Nom IUPAC Acide 2-hydroxybenzoïque Synonymes Acide orthohydroxybenzoïque No CAS No EINECS Code ATC , N02 PubChem FEMA SMILES InChI Apparence poudre cristalline incolore ou cristaux en forme d'aiguilles.[1] Propriétés chimiques Formule brute C7H6O3 [Isomères] Masse molaire 138,1207 g∙mol-1
C 60,87 %, H 4,38 %, O 34,75 %,pKa 3 Propriétés physiques T° fusion 159 °C[1],
Point de sublimation : 76 °C[1]T° ébullition 211 °C à 2666 Pa
(pression réduite)Solubilité dans l'eau à 20 °C : 0.2 g/100 ml[1],
bonne dans l'éthanolMasse volumique (eau = 1) : 1.4[1] T° d’auto-inflammation 540 °C[1] Point d’éclair 157 °C[1] Pression de vapeur saturante 1 mmHg ( 114 °C) Propriétés optiques Indice de réfraction 1,615 Précautions Directive 67/548/EEC 
XnPhrases R : 22, 41, Phrases S : 22, 24, 26, 39, NFPA 704 SIMDUT[2] 
Écotoxicologie LogP 2.2[1] Unités du SI & CNTP, sauf indication contraire. L'acide salicylique est un acide carboxylique incolore et cristallin utilisé comme médicament. (salicylique est l'adjectif de salicyline).
Sommaire
Utilité
L'acide salicylique est naturellement synthétisé par certains végétaux (comme la Reine-des-prés ou le Saule), on le retrouve notamment dans des fruits, sous forme estérifiée de salicylate de méthyle. Il peut agir comme un signal hormonal pouvant déclencher, dans certains cas, une thermogenèse végétale[3].
Ingéré en grandes quantités, c'est un produit toxique, mais en de moindres quantités il est utilisé comme conservateur alimentaire et antiseptique.
Les propriétés médicales de l'acide salicylique sont connues depuis longtemps, surtout pour son action contre la fièvre. On l'extrayait principalement du saule, salix en latin dont il tire son nom. Dans la lutte contre la fièvre, il est désormais supplanté par d'autres médicaments plus efficaces comme l'aspirine (qui en est un dérivé), ou le paracétamol.
Il est désormais plus utilisé pour son action apaisante (analgésique) et on le retrouve dans de nombreux produits en dermatologie en complément d'un autre principe actif. Il est par exemple utilisé dans le traitement de l'acné, des verrues ou de l'hyperhidrose.
Synthèse et Propriétés chimiques
Le groupement acide carboxylique (-COOH) peut réagir avec un alcool en donnant de nombreux esters. Le groupe hydroxyle peut réagir avec l'acide acétique pour former de l'acide acétylsalicylique, ou aspirine.
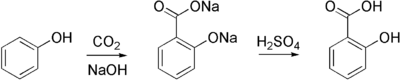
Industriellement, l'acide salicylique est synthétisé par la Réaction de Kolbe :
=> L'acide salicylique forme avec l'ion salicylate un couple acide/base de formule C6H4OHCOOH / C6H4OHCOO −
Toxicité
Vapeurs irritantes pour les muqueuses oculaires et respiratoires. Produit inflammable
Notes et références
- ↑ a , b , c , d , e , f , g et h ACIDE SALICYLIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Acide salicylique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Giberneau M, Brabé D, Des fleurs « à sang chaud », Pour la Science, Septembre 2007, p 50-56
Anti-acnéique Adapalène | Acitrétine | Isotrétinoïne | Clindamycine | Peroxyde de benzoyle | Acide salicylique - Portail de la médecine
- Portail de la chimie
- Portail de la pharmacie
Catégories : Produit chimique nocif | Principe actif | Acide hydroxybenzoïque
Wikimedia Foundation. 2010.