- Calomel
-
Calomel 
Modèles 2D et 3D Général Synonymes Dichlorure de dimercure
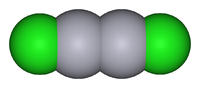
Chlorure mercureuxNo CAS No EINECS SMILES InChI Apparence poudre cristalline blanche[1]. Propriétés chimiques Formule brute Hg2Cl2 Masse molaire[2] 472,09 ± 0,04 g·mol-1
Cl 15,02 %, Hg 84,98 %,Propriétés physiques T° fusion Point de sublimation : 400 à 500 °C Solubilité dans l'eau : quasi-nulle (2,2×10-3 g·kg-1 à 20 °C) Masse volumique 7,15 g·cm-3[1] Thermochimie S0solide 192,52 J·mol-1·K-1 ΔfH0solide -265 kJ/mol Cristallographie Système cristallin Quadratique Réseau de Bravais Centré I Classe cristalline ou groupe d’espace 4/m 2/m 2/m Holoédrie tétragonale Propriétés optiques Indice de réfraction 1,97 - 2,65 Précautions Directive 67/548/EEC 
Xn
NPhrases R : 22, 36/37/38, 50/53, Phrases S : (2), 13, 24/25, 46, 60, 61, Transport - 2025 SIMDUT[3] 
SGH[4] 

AttentionMinéralogie Échelle de Mohs 1,5-2 Éclat adamantin Unités du SI & CNTP, sauf indication contraire. Le calomel ou chlorure mercureux est un minéral plutôt rare de formule Hg2Cl2. On le trouve généralement en association avec le cinabre. Il a été décrit pour la première fois en 1612 par De Mayenne en Allemagne.
Son nom vient du grec καλός (kalos) signifiant « beau », et μέλας (melas) signifiant « noir »[5]. Cette étymologie peut sembler étonnante pour un composé de couleur blanche, mais elle s'explique probablement par une référence à sa réaction caractéristique de dismutation avec l'ammoniac, qui, du fait de la formation de mercure sous forme métallique, donne une coloration noire :
-
- Hg2Cl2 + 2NH3 → Hg + Hg(NH2)Cl + NH4+ + Cl−
Utilisation
- Le calomel est utilisé en électrochimie pour la fabrication d'électrodes au calomel saturée (ECS). Le potentiel de cette électrode vaut : E° = 0,244 V à 25°C, dans KCl saturé. On utilise les ECS comme électrode de référence lors de nombreux titrages potentiométriques (mesure du pH, etc.).
Dans certains cas, comme durant les titrages de solutions contenant des ions argent, on est obligé de protéger l'électrode au calomel saturée pour éviter toute réaction entre ces ions métalliques et les ions chlorure du chlorure de potassium saturé de l'électrode qui la rendrait inutilisable (formation de précipité dans le corps de l'électrode). On protège alors le bout trempant dans la solution par une allonge contenant du nitrate de potassium. On peut également utiliser d'autres électrodes de référence comme celle au sulfate mercureux.
- Les monocristaux de calomel ont de nombreuses applications.
- Le calomel a eu des usages médicaux : notamment comme diurétique ou comme purgatif au XVIIe siècle. Plus récemment, en 1995-1996, des cas d'intoxications mercurielles dues à la présence de calomel ont été reportés aux États-Unis près de la frontière mexicaine. Le produit incriminé est une crème de beauté fabriquée à Mexico. Des analyses ont montré qu'elle contenait près de 8 % de mercure en masse. L’étiquette de cette crème mentionnait la présence de calomel comme ingrédient.
- Le calomel est toxique par ingestion, inhalation et par contact.
Notes et références
- CHLORURE MERCUREUX, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- « Chlorure de mercure(I) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Encyclopédie ou Dictionnaire raisonné des sciences, des arts et des métiers, entrée Calomel, tome 2, page 563.
- Portail des minéraux et roches
- Portail de la chimie
Catégories :- Composé du mercure
- Produit chimique nocif
- Produit chimique dangereux pour l'environnement
- Chlorure (minéral)
- Halogénure de métal
- Électrochimie
-
Wikimedia Foundation. 2010.

