- C7H6O
-
Benzaldéhyde
Benzaldéhyde 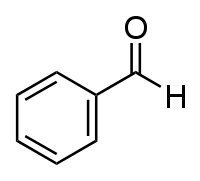
Général Nom IUPAC Aldéhyde benzoïque Synonymes phenylmethanal
Benzenecarboxaldehyde
Benzene carbaldehyde
AmandolNo CAS No EINECS FEMA SMILES Apparence liquide incolore à jaune visqueux, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C7H6O [Isomères] Masse molaire 106,1219 g∙mol-1
C 79,23 %, H 5,7 %, O 15,08 %,Propriétés physiques T° fusion -26 °C[1] T° ébullition 179 °C[1] Solubilité légèrement soluble dans l'eau (04 % à 25 °C)
éthanol,éther,acétone,benzèneMasse volumique vapeur 3,66
liquide 1,046 (20 °C)T° d’auto-inflammation 190 °C[1] Point d’éclair 62 °C[1] Limites d’explosivité dans l’air en volume % dans l'air : 1.4-13.5[1] Pression de vapeur saturante à 26 °C : 130 Pa[1] Viscosité dynamique 1,4 cP (25 °C) Précautions Directive 67/548/EEC 
XnPhrases R : 22, Phrases S : (2), 24, Transport - 1990 NFPA 704 SIMDUT[2] 

SGH[3] 
AttentionÉcotoxicologie LogP 1.48[1] Unités du SI & CNTP, sauf indication contraire. Deux chimistes, Friedrich Wöhler et Justus Liebig analysent, en 1832, l'essence d'amande amère dans laquelle ils trouvent du benzaldéhyde C7H6O. En isolant le composé et en le faisant réagir, ils se rendent compte qu'un groupement, qu'ils nomment radical benzoyle C7H5O, reste inchangé.
Le benzaldéhyde est un liquide incolore à odeur d’amande amère, c'est l'aldéhyde aromatique le plus simple. Une molécule proche du benzaldéhyde, le phényléthanal sent la jacinthe et on l’utilise en parfumerie sous le nom de hyacinthine. On utilise le benzaldéhyde dans le kirsch fantaisie (note de noyau), la colle blanche et le traitement des vins. Il est présent dans les pêches, le raisin, les fraises et les framboises et est responsable de l'odeur des airelles.
Sommaire
Préparation
On prépare le benzaldéhyde par l'oxydation du toluène ou par hydrolyse du diméthylchlorobenzène.Il se forme également par hydrolyse de l'amygdaline présente dans les amandes et dans les noyaux de certains fruits (abricots..)
Propriétés chimiques
La combustion complète du benzaldéhyde donne du dioxyde de carbone et de l'eau.
Le benzaldéhyde peut être oxydé en acide benzoïque C6H5-COOH à odeur désagréable. Cette réaction d'autooxydation survient lentement à l'air à température ambiante ce qui explique qu'on le conserve sous une atmosphère d'azote.
En milieu basique, il peut donner lieu à une réaction de Cannizzaro.
Pour caractériser le benzaldéhyde (et les aldéhydes) , on le fait agir sur l'hydrazine H2N-NH2) ou ses dérivés comme la phénylhydrazine. C6H5-NH-NH2.
Utilisations
- parfumerie produits odoriférants.
- alimentation: préparation du cinnamaldéhyde et des ses dérivés.
- arômes artificiels d'amande et de cerise.
- intermédiaire industriel pour la fabrication d'acide benzoïque.
- solvant: résines, acétate et nitrate de cellulose.
- colorants
- pesticides: éphédrine.
- répulsif des abeilles lors de la récolte du miel.
Liens externes
- oxydation du benzaldéhyde
- International Chemical Safety Card 0102
- European Chemicals Bureau
- Benzaldehyde description at ChemicalLand21.com
Références
- ↑ a , b , c , d , e , f , g et h BENZALDEHYDE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Benzaldéhyde » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Produit chimique nocif | Benzaldéhyde | Arôme
Wikimedia Foundation. 2010.

