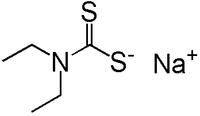
- C5H10NNaS2
-
Dithiocarbamate
Dithiocarbamate diéthyldithiocarbamate de soude Général Synonymes Diéthyldithiocarbamate de sodium No CAS No EINECS PubChem SMILES InChI Apparence Blanc tendant sur le brun, ou cristal rosé (forme solide) Propriétés chimiques Formule brute C5H10NNaS2 [Isomères] Masse molaire 171,259 g∙mol-1
C 35,07 %, H 5,89 %, N 8,18 %, Na 13,42 %, S 37,45 %,
(anhydre)Propriétés physiques T° fusion 90 à 102 °C[1] Solubilité Soluble Masse volumique (eau = 1) : 1.1[1] Précautions Directive 67/548/EEC 
Xi
NPhrases R : 36/37/38, 50/53, Phrases S : 60, 61, Classification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[2] Écotoxicologie DL50 3 g⋅kg-1 (souris, i.p.)
2,7 g⋅kg-1 (rats, i.p.)Unités du SI & CNTP, sauf indication contraire. Les dithiocarbamates sont une famille de composés organiques (biocides, toxiques, synthétisés à partir de dérivés de l'acide dithiocarbamique et des thiurames. Ils sont généralement utilisés comme fongicides ou additifs de pesticides ; désherbants ((diallate, triallate, E P T C) ou insecticides ; carbaryl par exemple)
Le diéthyldithiocarbamate de sodium est le composé chimique de formule NaS2CN(C2H5)2. Ce sel est obtenu en soumettant du Sulfure de carbone avec une diéthylamine en présence d'Hydroxyde de sodium. Beaucoup de dithiocarbamates peuvent être d'une manière similaire préparés à partir d'amines et de Sulfure de carbone.
Il a été utilisé comme médicament ;
- contre le cancer pour son action chélatrice et synergique avec des métaux toxiques utilisés sous forme de diéthyldithiocarbamate également appelés ditiocarbe ou ditiocarbe sodique (= principal métabolite du disulfirame) pour tuer les cellules cancéreuses (en association avec du carboplatine pour un traitement moins toxique qu'avec du cisplatine pour le cancer de l'ovaire par exemple[3],[4])
- et comme antirétrovirus (ex : Imuthiol du laboratoire Pasteur-Mérieux)contre le SIDA (retiré en 1991 de la vente pour ce dernier usage, car deux premières études avaient laissé penser que l'imuthiol pouvait diminuer l'infection par le HIV, les patients qui l'ont utilisé lors de l'essai randomisé HIV 87 (10 mg/kg par voie orale une fois par semaine avec suivi de 24 semaines de 1 333 patients inclus dans 20 centres, la moitié de ces patients recevant un placebo) ont finalement été plus nombreux à mourir et ont développé un sida plus rapidement pour ceux qui étaient porteurs asymptomatiques)[5],[6].
Sommaire
Histoire
Ces produits sont apparus sur le marché dès 1930 pour le zirame, dès 1937 pour le thirame et un peu plus tardivement pour le zinebe (1943), le manebe (1950 ) et le mancozebe (1961).
Familles ( source : ACTA 1975[7], et ENGST et al.[8] pour les DL 50.)
Dérivés de l'acide dithiocarbamique :
- di-méthyl-dithiocarbamate de fer (ferbame : DL50 pour le rat: 7 500 mg/kg)
- di-méthyl-dithiocarbamate de zinc (zirame: DL50 pour le rat: 500 mg/kg)
- di-méthyl-dithiocarbamate de mercure (composés mercuriels inorganiques (POP) très toxique [9])
- éthylène-bis-dithiocarbamate de sodium (nabame : DL50 pour le rat: 395 mg/kg)
- éthylène-bis-dithiocarbamate de zinc (zinèbe : DL50 pour le rat: 5 200 mg/kg)
- éthylène-bis-dithiocarbamate de manganèse et de zinc (manèbe ; DL50 pour le rat: 5000 à 7 500 mg/kg selon les produits testés)
- éthylène-bis-dithiocarbamate de manganèse et de zinc (mancopper)
- éthylène-bis-dithiocarbamate de zinc (mancozèbe DL50 pour le rat: 8 000 mg/kg)
- propylène-bis-dithiocarbamate de zinc (propinèbe : DL50 pour le rat: 14 000 mg/kg)
- méthyl-dithiocarbamate de sodium (métam-sodium)
- bis-chlorure di-méthyl-dithiocarbamate tri cuivreux (cuprobame)
Dérivé de thiurames :
- disulfure de bis diméthyl-thiolcarbamyle (thirame)
- disulfure de tétraméthyl (thirame)
Usages
Ces produits sont utilisés (soumis à réglementation) :
- comme chélateur (par exemple pour capter le Cadmium en cas d'intoxication aiguë par du cadmium) mais avec l'inconvénient de transporter ce métal toxique vers le cerveau)[10]
- comme pesticide ; fongicides, notamment pour les cultures maraîchères, céréales, arbres fruitiers, vignes, etc. y compris en zones humides, par exemple pour les cressicultures non-bio...)
- comme molécule de base pour la synthèse organique d'herbicides
- comme agent de vulcanisation.
Ils se décomposent lentement lorsqu'exposés à la chaleur et à la lumière, mais en produisant éventuellement des métabolites toxiques[11].
(À des taux élevés, le sulfure de carbone peut être mortel via son action sur le système nerveux)Législation
Les dithiocarbamates, en raison de leur toxicité pourraient être retirés du marché européen (mancozèbe, manèbe, metirame..)[12].
La teneur maximale autorisée en résidus de dithiocarbamate, exprimés en CS2, dans les céréales est de 2 mg/kg pour l'orge et l'avoine, 1 mg/kg pour le blé. Ils sont interdits pour les autres céréales[13].
Références
- ↑ a et b DIETHYLDITHIOCARBAMATE DE SODIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ ROTHENBERG M. L. & al. « High-dose carboplatin with diethyldithiocarbamate chemoprotection in treatment of women with relapsed ovarian cancer » ; Journal of the National Cancer Institute ;Oxford University Press, ISSN:0027-8874 1988, vol. 80, no18, pp. 1488-1492 (14 ref.) ; Fiche INIST CNRS
- ↑ Prudence Francis & al. « Diethyldithiocarbamate chemoprotection of carboplatin-induced hematological toxicity » ; Journal of Cancer Research and Clinical Oncology Éd:Springer Berlin / Heidelberg ; ISSN:0171-5216 (Print) ISSN:1432-1335 (Online), Volume 119, N°6 / juin 1993 ; DOI:10.1007/BF01208846 ; pp 360-362 ; Voir
- ↑ Article intitulé Les résultats définitifs de l'essai HIV 87 justifient l'arrêt de développement du ditiocarb (Imuthiol®), par Jean-François Chambon, Directeur médical d'Arcat-sida(Paris), Revue critique de l'actualité scientifique internationale sur le VIH et les virus des hépatites n°15 - avril-mai 97
- ↑ 7 - Fontenay F. « Distribution suspendue de l'Imuthiol. Une décision sans retour » ; Le Journal du sida, 1991, 31/32, 15-18
- ↑ (Association de Coordination Technique Agricole) Index des produits phytosanitaires, 12e éd. 367 p.
- ↑ ENGST R., SCHNAAK ,W., 1974. Residue of dithiocarbamate fungicides and their metabolites on plant foods. Res. Rev. 52 : 45 — 67
- ↑ Fiche Info (anglais)
- ↑ Robert R Lauwerys & al. ; Toxicologie industrielle et intoxications professionnelles, Masson (plusieurs rééditions), p 221 [ http://books.google.fr/books?id=OhEORFmKAi4C&pg=PA221&lpg=PA221&dq=Dithiocarbamate+toxicit%C3%A9&source=web&ots=YEeZge0uAh&sig=P1QWLG2basp2Ogf8d0EXXO4pVBo&hl=fr&sa=X&oi=book_result&resnum=5&ct=result Voir]
- ↑ BONTOYAN W.R., LOOKER J.B., 1973. Dégradation of commercial Ethylene Bisdithiocarbamate formulations to Ethylene thiourea under elevated température and humidity. J. Agr. Food Chem. 21 (3) 338-41
- ↑ Proposition (2008) de nouveaux critères d’exclusion, par la Commission européenne et le Parlement européen. Article de Vitinet (consulté 2008 12 12)
- ↑ Teneurs maximales en résidus de pesticides admissibles sur et dans les céréales, Arrêté du 17 décembre 2007
Toxicologie
La toxicité de cette famille de produits varie selon le composé (plus son poids moléculaire est élevé et plus il contient de noyaux benzéniques, plus il est toxique[1])et d'éventuelles synergies avec par exemple des métaux lourds. Elle est connue depuis les années 1960 au moins et on savait également doser ces molécules assez précisément à cette époque[2] Ce sont des produits dont la solubilité dans l'eau varie ; Le mancosèbe et le manèbe le sont très peu, le zinèbe et le thirame le sont plus (10 mg/l à une température de 20 °C et plus au delà) (Martin Hubert, 1971.), Ils s'adsorbent facilement sur la matière organique et peuvent persister plusieurs semaines ainsi[3].
Produits de dégradation (toxiques et apparaissant plus vite quand la température et l'humidité augmentent selon ENGST et SCHNAAK (1974) :
- EBIS (Ethylène—Bs—IsothiocyanateSulfide)
- ETU (Ethylène—Thio—Urea)
Ces produits peuvent apparaitre dans le bidon avant utilisation (jusqu'à 14 % d'ETU trouvé par BONTOYAN W.R. et LOOKER J.B. (1973) dans des formules commercialisées.
Écotoxicologie
Cette famille de produit est toxique pour de nombreux animaux, dont les invertébrés aquatiques[4], de même que ses métabolites (selon des tests fait par exemple sur le Cilié Tetrahymena pyriformis [5]. Ces ciliés transforment le produit (bioconversion) en métabolites autant ou plus toxiques que la molécule mère (Fongicide Thirame en l'occurrence). Le produit utilisé sur le cresson a des effets toxiques sur les poissons qui les concentrent au moins dans le foie et les reins (engourdissements puis mortalités importantes dans des piscicultures situées en aval de cressicultures)[6]. Selon BARBIER B. et CHAMP P.(1975), d'après des tests de court terme sur le vairon (Phoxinus phoxinus L.) exposé à du THIRAME, ZINEBE, MANEBE, MANCOZEBE., ces 4 produits se sont avérés très toxiques ; surtout le THIRAME avec une CL50 96 h de 0,0159
Reprotoxicité
Un effet perturbateur endocrinien semble possible : des cailles intoxiquées par du Thirame (elles y sont exposées via le traitement de semences) ont présenté des troubles de la reproduction (avec atteinte testiculaire chez le mâle et un inhibition de la ponte chez la femelle. Ces troubles étaient réversibles[7].
Annexes
Articles connexes
Liens externes
Notes et références
- ↑ N. Segovia & al. ; In vitro toxicity of several dithiocarbamates and structure-activity relationships ; Journal of Applied Toxicology Volume 22, Issue 6 , Pages353 - 357 Ed : John Wiley & Sons Voir
- ↑ Répression des fraudes 1968. Méthodes officielles de recherche des résidus de pesticides. J.O. Brochure n° 68 — 191
- ↑ études de MESHEIM et LINN (1968) sur le Thirame (cité par GORING Clève A . l . et HAMAKER J.W., 1972)
- ↑ Jacqueline Seugé & Roger Bluzat ; toxicité aiguë d'un fongicide dithiocarbamate, le thirame, chez des larves de l'éphémère Cloeon dipterum : effets de divers paramètres ; Hydrobiologia Éd : Springer Netherlands ; ISSN:0018-8158 (Print) ISSN:1573-5117 ; juillet 2006 (Online)Voir
- ↑ Fiche INIST CNRS
- ↑ R. BELAMIE, D. LINTIGNAT, D. RIDET and O. GARAT , Propriétés générales et toxicité à l'égard des poissons de certains fongicides utilisés dans les cressonnières ; Bull. Fr. Piscic. (1977) 266 : 1-10 ; DOI:10.1051/kmae:1977003, 1977 Voir
- ↑ LORGUE G., DELATOUR P., COURTOT D., GASTELLU J., MACKOWIAK M., 1975. Étude sur la caille des effets toxiques du Thirame, fongicide du groupe des dithiocarbamates. Revue Méd. Vét. 126 (3) : 365 — 381.
- Portail de la chimie
- Portail de la mycologie
Catégories : Composé du sodium | Produit chimique irritant | Produit chimique dangereux pour l'environnement | Fongicide | Sulfure | Agent chélatant
Wikimedia Foundation. 2010.