- C2N2
-
Cyanogène
Cyanogène 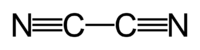
Général Nom IUPAC Ethanedinitrile Synonymes oxalonitrile No CAS Apparence gaz incolore ou gaz comprimé liquefie, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C2N2 [Isomères]
NCCNMasse molaire 52,0348 g∙mol-1
C 46,16 %, N 53,84 %,Propriétés physiques T° fusion -27,9 °C[1] T° ébullition -21,2 °C[1] Solubilité dans l'eau à 20 °C : 450 ml/100 ml[1] Masse volumique (eau = 1) : 0.95 at -21 °C[1] Point d’éclair Gaz Inflammable[1] Limites d’explosivité dans l’air en volume % dans l'air : 6.6-42.6[1] Précautions Directive 67/548/EEC 
T
F
NPhrases R : 11, 23, 50/53, Phrases S : (1/2), 23, 45, 60, 61, Transport - 1026 NFPA 704 SGH[2] 



DangerÉcotoxicologie LogP 0.07[1] Unités du SI & CNTP, sauf indication contraire. Le cyanogène (en anglais cyanogen ou carbon nitride) est un gaz incolore dont l'odeur est proche de celle de l'amande.
Autre sens du mot : adjectif caractérisant la propriété de provoquer une cyanose ("bleuissement de la peau") par diminution de l'oxygénation du sang. On parle par exemple de cardiopathie congénitale cyanogène.
Sommaire
Propriétés
Formule chimique (CN)2 (N≡C-C≡N).
Masse molaire 52.04 g.mol-1
Densité de vapeur 1.8 (air=1)
Température d'autocombustion : >650 degrés C
Il est soluble dans l'eau
Il réagit avec les acides et les oxydants forts (ozone,monoxyde de chlore, chlorates, nitrates, nitrites, fluor) et peut ainsi entraîner une explosion (d'où une possible utilisation comme propergol pour les fusées).
Le cyanogène se polymérise sous l'action de rayons ultraviolets en un solide noir (paracyanogène (CN)x), qui, chauffé en vase clos, se transforme en cyanogène par une réaction limitée et réversible.
Historique
Le cyanogène a probablement été synthétisé pour la première fois par Carl Wilhelm Scheele en 1782. En 1802, il est utilisé pour produire du chlorure de cyanogène.
En 1815, Louis Joseph Gay-Lussac étudie les composés de la série du cyanogène. Il note que, dans toutes ses expériences, un CN reste inchangé qu'il nomme le radical cyanogène.
Depuis la fin du XIXe siècle (et encore de nos jours) il est utilisé comme précurseur de nombreux engrais : on le retrouve dans l'eau potable a des concentrations extrêmement faibles.
Le cyanogène est aussi utilisé dans la production de nitrocellulose.
Préparation
On peut obtenir le cyanogène en laboratoire par chauffage au rouge du cyanure de mercure ou d'un mélange de cyanure alcalin et de chlorure mercurique. Il s'unit à l'hydrogène pour donner l'acide cyanhydrique.
Combustible, il brûle en donnant de l'azote et, selon la quantité d'oxygène, du gaz carbonique ou de l'oxyde de carbone. Son hydratation est catalysée par les acides et fournit divers produits.
En présence de bases, le cyanogène réagit comme un halogène et donne un mélange de sels d'hydracide et d'acide oxygéné :
(CN)2 + 2KOH → KCN + KOCN + H2O
Effets d'une exposition
Le cyanogène est un gaz très toxique : il est métabolisé en cyanure et inhibe l'action de l'hémoglobine et surtout de la cytochrome oxydase, enzyme terminale de la respiration oxygénée.
Sa manipulation nécessite une protection pour les yeux et l'utilisation d'un appareil respiratoire autonome. Une inhalation provoque des troubles graves pouvant aller jusqu'à l'arrêt respiratoire et la mort.
Les risques liés à l'ingestion ne sont pas bien connus.
Composés
- iodure de cyanogène
- bromure de cyanogène
- chlorure de cyanogène
Références
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique facilement inflammable | Produit chimique dangereux pour l'environnement | Gaz | Cyanure
Wikimedia Foundation. 2010.


