- Sphaerotilus natans
-
 Sphaerotilus natans
Sphaerotilus natans
Filasses bactériennes fixées de sphaerotylus Classification Règne Bacteria Embranchement Proteobacteria Classe Beta Proteobacteria Ordre Burkholderiales Famille Comamonadaceae Genre Sphaerotilus Nom binominal Sphaerotilus natans
Kützing, 1833Sphaerotilus natans est une bactérie filamenteuse aquatique à coloration de Gram négatif.
Elle était autrefois surtout connue pour proliférer dans certains milieux ferrugineux (classée jusque dans les années 50 comme iron bactéria (bactérie ferrugineuse) par Pringsheim[1],[2]qui les a étudié dans les années 1940 et par Stokes dans les années 1950[3] elle a la propriété de pouvoir respirer en utilisant l'atome d'oxygène du fer oxydé) et de pouvoir précipiter le fer dans sa gaine protectrice), mais a été ensuite souvent trouvée dans certaines eaux polluées et processus industriels où elle peut poser problème.Cette bactérie ou les associations qu'elle peut constituer, pourraient peut-être, dans certaines conditions être pathogènes[4].
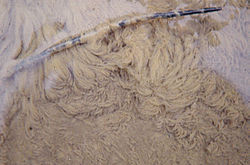 Filasse bactérienne essentiellement constituée de bactéries Sphaerotilus natans, ici tapissant (dans les années 1990) le fond de la rivière Aa, au point d'y étouffer toute la flore et la plupart des organismes (hormis larves de chironome plumeux, tubifex et une espèce de petite sangsue particulièrement résistantes. L'eutrophisation était maximale à Blendecques où est prise cette photo, après le point de rejet de la quatrième papeterie de la vallée, dans le centre de la commune, et en zone inondable). La branche donne l'échelle des filaments ; son diamètre est d'environ 1 cm. Depuis, un changement de process industriel a permis la suppression de ce tapis bactérien.
Filasse bactérienne essentiellement constituée de bactéries Sphaerotilus natans, ici tapissant (dans les années 1990) le fond de la rivière Aa, au point d'y étouffer toute la flore et la plupart des organismes (hormis larves de chironome plumeux, tubifex et une espèce de petite sangsue particulièrement résistantes. L'eutrophisation était maximale à Blendecques où est prise cette photo, après le point de rejet de la quatrième papeterie de la vallée, dans le centre de la commune, et en zone inondable). La branche donne l'échelle des filaments ; son diamètre est d'environ 1 cm. Depuis, un changement de process industriel a permis la suppression de ce tapis bactérien.
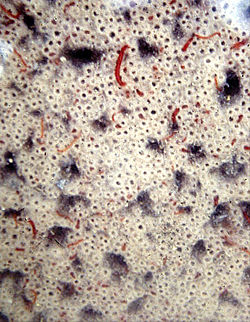 Association (symbiose ou simple commensalisme ?) entre larves de chironomes et bactéries filamenteuses (Aa, vers 1990), sur le fond de la rivière, entièrement tapissé de larves et bactéries. Chaque trou est l'entrée d'un fourreau de larve, construit par la larve avec des bactéries
Association (symbiose ou simple commensalisme ?) entre larves de chironomes et bactéries filamenteuses (Aa, vers 1990), sur le fond de la rivière, entièrement tapissé de larves et bactéries. Chaque trou est l'entrée d'un fourreau de larve, construit par la larve avec des bactéries
 Feuilles d'une plante aquatique (rubanier) entièrement couverte d'une moquette constituées de bactéries filamenteuses fixées. Noter la « raie » marqué par la nervure de la feuille
Feuilles d'une plante aquatique (rubanier) entièrement couverte d'une moquette constituées de bactéries filamenteuses fixées. Noter la « raie » marqué par la nervure de la feuille
.
Caractéristiques générales
Cette espèce est chimiohétérotrophe.
Respiration : Cette espèce est considérée par la littérature comme aérobie, et sa préférence en culture pour les milieux oxygénés est indéniable. Mais il n'est pas certain qu'elle soit strictement aérobie. Stoke a ainsi maintenu en vie et en croissance certaines de ses souches cultivées en l'absence supposée d'oxygène (par exemple dans une atmosphère constituée uniquement d'azote) ; Stoke pose cependant l'hypothèse que de très faibles teneur en oxygène lui suffisent. Elle pullule en effet parfois en milieu industriel ou dans de eaux très polluées à un stade proche de l'anoxie (notamment la nuit). Les pullulations sont dans ce cas cependant souvent associées à un contexte d'eau agitée (épuration à lit fluidisé, rivière ou fossé à courant) ou elles sont proches de la surface où elles peut par contact avec l'air se fournir en oxygène.
Cette espèce peut capter l'oxygène du fer oxydé et probablement de la molécule de nitrate (alors réduits en nitrites), mais pas de KNO.
Les cellules de sphaerotilus ne sont en tous cas pas lésées par un stockage de plusieurs semaines en anaérobiose stricte.Elle prend deux formes (mieux décrites plus bas) : Elle se présente sous deux formes :
- Forme en bâtonne, nageant librement est considérée comme une ou forme libre et mobiles (grâce à un flagelle ou cil polaire). Chaque bâtonnets mesure de 1 à 2,5 µm de large et de 2,5 à 16 µm de long (3 à 8 dans la plupart des cas), entourés d'une gaine protectrice (on les dits engainées[5]),
- forme filamenteuse, le plus souvent fixée sur un substrat, coloniale, avec aspect caractéristique de filasses bactériennes ondulant dans le courant.
Histoire Dénomination, étymologie
Cette bactérie a d'abord été décrite et nommée par Küttsing (1833) qui l'a trouvé en grand nombre dans des eaux polluées, puis redécouverte plus tard par Cohn (1875) mais sous une forme faussement branchue (à deux branches), qui l'a fait nommer Cladothrix dichotoma avant qu'on ne considère qu'il s'agisse de la même bactérie, Pringsheim (1949) ayant montré que S. natans présente cette forme dichotomique à fausse ramification chaque fois que cultivée dans des milieux à faible teneur en matière organique. Elle ne semble toutefois pléomorphes que dans des conditions non optimales ou peut être associée à d'autre espèces (Zopf (1882) trouve S. natans très pléomorphes lorsque ses cellules en bâtonnets sont associées à des microcoques, vibrions, spirilles et spirochètes avec les cellules de tige d'habitude en forme.). En souche pure de culture ce sont les formes non branchues qu'on observe. C'est Büsgen (1894[6]) qui a le premier réussi à obtenir une cultures pures de cette bactérie, à partir de filaments trouvés dans de l'eau courante polluée et cultivés sur de la gélatine de viande.
Les cultures pures étaient difficile à obtenir car d'autres bactéries ou organismes étaient importés dans les cultures, attachés à la gaine gélatineuse des Filaments de Sphaerotilus, et contaminent ensuite la culture sur gélose. Stokes a résolu ce problème en séchant la surface de gélose stérile (par stockage durant 12 h des préparations de gélose stérile à 37 ° C pour en ôter l'excès d'humidité superficielle), avant introduction de Sphaerotilus [3].
Étymologie
Le nom de genre Sphaerotylus vient du mot latin sphaera qui signifie sphère et du grec Tilos (qui évoque un troupeau ou un ensemble de notes de musique flottant dans l'air), décrivant ici le fait que ces bactéries forment des amas sphériques.
Le nom d'espèce natans vient du latin et signifie « qui nage ».Synonymes : Le genre a aussi été appelée
- Cladothrix" (par Cohn en 1875)
L'espèce a aussi été appelée
- Cladothrix dichotoma" Cohn 1875 ;
- "Streptothrix fluitans" Migula 1895 ;
- "Sphaerotilus fluitans" (Migula 1895) Schikora 1899 ;
- "Sphaerotilus dichotomus" (Cohn 1875) Migula 1900.
Le nom de genre de cette bactérie ne doit pas être confondu avec celui d'éponges telles que Sphaerotylus antarcticus (qui s'écrit avec un « y » à la place du « i »)
Certaines souches sont nommées (ex : Strain ATCC 13338 = DSM 6575 = LMG 7172)
Écologie
Habitat : Bien qu' a priori commune dans les eaux résiduaires, les égouts, certains fossés pollués et marécages, certaines eaux douces, rivières, lacs et certaines nappes souterraines, cette bactérie semble assez mal connue pour ses formes « sauvages ».
Certaines de ses souches sont mieux connues du monde industriel et des gestionnaires de station d'épuration[7] ou de boues d'épuration de papeteries[8]. J. Water Pollut. Control Fed. 57:68-81.</ref>. Les Sphaerotilus, quand elles disposent des nutriments leur convenant, se développent en effet très bien dans des milieux très faiblement oxygénés (boues de station d'épuration activée[9],[10],[11],[12]) et parfois dans des fossés de décharge, ou dans la rivière en aval de stations d'épuration dysfonctionnant.
Ces bactéries semblent capables d'utiliser de nombreux types de composés de carbone organique : Elles peuvent métaboliser (l'équivalent de la digestion pour une bactérie) les polysaccharides, sucres (glucose, galactose, saccharose, maltose), polyols qui sont un intermédiaire entre sucre et alcool (mannitol, sorbitol), acides organiques, succinate, fumarate, butyrate, le butanol, glycérol, lactate de sodium, pyruvate de sodium, acétate de sodium, éthanol et certains alcools (à faibles doses) comme source de carbone. Cataldi y ajoutait (en 1939[13]) le citrate et l'asparagine. Selon Linde (1913 [14]), les dextrines-polysaccharides, la gomme arabique, l'amidon, l'inuline, et la cellulose ne pouvaient permettre à eux seuls la croissance de S. natans en culture.
Les sphaerotilus peuvent aussi utiliser des sources variées d'azote (minéral ou organique, à partir de chacun des acides aminés, des mélanges d'acides aminés ou de substances azotées complexes telles que la peptone ou des extrait de viande. Le type d'azote et l'assimilation varient semble-t-il selon les souches étudiées et peut-être selon les conditions du milieu de culture (incluant les types de sources de carbone exploitées) [3].
Un extrait de sol stimule la croissance des souches cultivées en laboratoire probablement via un apport en sels minéraux, car un ajout de MgSO4, CaCl2, et FeCl3 a selon Stoke[3] le même effet.L'acétate et le butyrate et certains biocides (chlorés notamment) se montrent faiblement toxique ou non toxique pour les Sphaerotilus à des doses qui inhiberaient la croissance de la plupart des autres bactéries. La croissance est inhibée à partir ce certains seuils avec le xylose, arabinose, le benzoate de sodium, le propionate de sodium, le propanol, ou le méthanol.
L'optimum de reproduction des souches sauvages semble être d'environ 30°C, mais des souches mutantes industrielles sont plus tolérantes à la chaleur, d'au moins 10°C.
Formes libres ou fixées
On ne comprend pas clairement ce qui fait que la bactérie se fixe en formant des filaments ou prend une forme libre. L'environnement chimique, mais aussi la force du courant semblent avoir une importance déterminante[15].
Les Sphaerotylus peuvent dans certaines conditions (notamment en présence de sucres ou d'une grande quantité de matière organique, ou exposée à certains stress) présenter des forme filamenteuses très longues (jusqu'à 500 µm) qui s'associent entre elles et avec d'autres espèces pour former des filasses bactériennes fixées (et parfois en suspension).
Dans les papeteries, et en aval des stations d'épuration qui ont dysfonctionné, elles peuvent dans ces cas emprisonner dans leur « toile » des fibres de cellulose en suspension, des micro-organismes, et s'associer à d'autres organismes cyanobactéries, Microthrix parvicella[16]...) ou Leptothrix, protozoaires et champignons et former des macrostructures de type coloniales particulières (biofilms [17], flocs bactériens ou filasses bactériennes qui ne sont pas des biofilms), libres ou accrochées).
Elles peuvent aussi « stabiliser » des colonies d'autres organismes (éventuellement pathogènes) tels que Klebsiella sp. et Pseudomonas sp.
Les anglophones appellent ces communautés « sewage fungi »[18] (« champignon des eaux usées »). Dans certaines parties de machines à papier, qui constituent des milieux chauds, saturés en humidité et riches en nutriments, des communautés bactériennes particulières à sphaerotilus peuvent aussi se développer[19] .Des foisonnements intense de cette bactéries ont été fréquemment constatées dans certaines stations d'épuration (de papeteries notamment quand elles utilisent de l'amidon ou certains sucres dans les enduits de couchage) en Europe, Amérique et jusqu'en Nouvelle-Zélande [20]. Elle forme dans les stations d'épuration, les égouts, tuyaux ou fossés de décharge des masses cotonneuses (de texture externe mucilagineuse et gluante), qui flottent à la surface et peuvent et empêche le phénomène de floculation, et parfois des tapis filamenteux (plus en aval).
Sur des eaux extrêmement polluées et mal épurées, les filaments en suspension peuvent parfois sécher au soleil à la surface de l'eau et y former des croûtes.
Elles prolifère dans certaines eaux usées (de papeteries [21], abattoirs...) en montrant pour certaines souches mutantes une résistance aux biocides (eau de Javel y compris).Dans la nature, les Sphaerotilus font partie des bactéries qui contribuent à dénitrification les nappes (par voie autotrophique), avec un composé oxydable qui est le fer (Fe) réduit (tandis que la proche bactérie Sphaerotylus discophorus peut aussi utiliser l'ion manganeux du manganèse (Mn) en l'absence de fer, prenant alors au microscope une couleur caractéristique permettant de la différentier[3]), et alors que d'autres bactéries comme les Thiobacillus utilisent le soufre réduit. D'autres bactéries dénitrifient l'eau au moyen du fer, ce sont par exemple Gallionella, Leptothrix et Ferrobacillus[22]. Ces bactéries sont dans la nature courantes dans les eaux ferrugineuses où elles forment des touffes de filasses bactériennes ondulant dans le courant.
Culture
Parmi les trois types de formes coloniales bactériennes distinguées par la microbiologie, S. natans issue du milieu naturel produit d'abord une forme filamenteuse correspondant au "TYPE R" (rough=rugueux ; contours irréguliers, plates rugueuses et mates, sèches) qui semble proche de la forme filamenteuse naturelle, mais en cultures de laboratoire sur substrat, les filaments se dissocient pour donner des colonies de formes de "type S" (smooth=lisse): colonies aux contours lisse et réguliers, semi-bombée, aux surface brillantes et crémeuses. Des formes intermédiaires, avec un centre lisse et des bords plus irréguliers existent. Selon Stokes, la forme S apparaît plus vite sur des substrats riches[3].
Les bactéries individualisées de la forme S peuvent être au début du processus de différentiation confondues avec d'autres bactéries en bâtonnet (Pseudomonas notamment).la forme libre mise en culture peut former des films sur les parois, des granules, un film de surface, plus épais et gluant, l'eau devenant légèrement plus turbide si on agite le flacon de culture[3].
Bioindication
Lorsqu'elles pullulent, elles sont bioindicatrices d'une forte pollution organique de l'eau, qu'elles contribuent par ailleurs probablement à dépolluer.
Génétique et génomique
Classification Cette espèce est classée dans la subdivision beta-1 de la classe Proteobacteria.
Les Spaerotilus semblent proches des bactéries du genre Leptothrix(famille des comamonadaceae) [23],[24]. Certains auteurs les regroupent[25]. E. G. Pringsheim les considère comme des phénotypes de Sphaerotilus et non un genre à part entière. Pour certains auteurs, les Leptothrix fixent le fer et le manganèse, alors que les Spaerotilus ne fixeraient que le fer ou très préférentiellement le fer.
Certains gènes (16S rRNA) ont été séquencés[26] ou étudiés pour l'étude phylogénétique[27] de cette bactérie, ainsi que de Leptothrix discophora [28], mais aucun génome complet de Sphaerotilus ne semble avoir à ce jour été séquencé. La taxonomie de cette espèce pourrait évoluer à l'avenir.
Structure[29], reproduction et métabolisme
Forme filamenteuse : Sphaerotilus natans est dans sa forme naturelle la plus courante une bactérie coloniale formant des filaments constitués de chapelets de cellules en forme de bâtonnets rigides, protégés dans une longue gaine tubulaire aux extrémités arrondies, fine et transparente, mais cohérente et assez solide pour le pas casser quand elle est pliée sur elle-même, y compris à angle très vif (Stokes [3]). Cette gaine protectrice est hygroscopique (hyaline ou parfois incrustée d’hydroxyde de fer (ou de manganèse ?) en eau courante ferrugineuse). Cette gaine est souple et ajustée aux bactéries et elle tend à s'amincir ou s'aplatir quand elle n'est pas tendue par les cellules qu'elle contient (les vides séparant certaines bactéries de leur gaine sur les microphotographies de préparations sèches sont dus à la contraction des bactéries lors de leur déshydratation). Stokes compare la gaine à une sorte de tuyau de fin cellophane qui contiendrait le chapelet de bactéries[3]. Jusqu'à 50 % des gaines apparaissent vides[3] mais elles pourraient ainsi peut-être encore jouer un rôle pour la cohérence de la colonie.
Il semble exister des formes atypiques (ex. : deux voire trois trains de cellules dans une même gaine, selon Stokes[3]. Les bactéries semblent alors plus fines[30]) ou mutantes en termes de taille, formes branchues, ou résistance de ces gaines à la température ou à des biocides.
Les cellules sont libres dans la gaine (comme chez d'autres bactéries des genres Leptothrix, Haliscomenobacter, Lieskeella, Phragmidiothrix, Crenothrix, Clonothrix). Une couche de type mucilagineuse et hygroscopique entoure le chapelet de bactérie engainées, jouant probablement un rôle de protection contre la déshydratation, les ultra-violets et facilitant peut-être et l'agglomération de filaments entre eux et une certaine lubrification permettant l'ondulation des filaments dans le courant.
Cette gaine est composée de sucres (et d'un peu de lipides et de protéines ?). Elle est entourée d'un exopolysaccharide acide fait de molécules de glucose, fructose, galactose et acide glucuronique[31]. Lorsque la bactérie se divise elle ne sépare pas, mais les bactéries s'accrochent les unes aux autres, par leur extrémité, et constitue ainsi un chapelet qui finit par former un filament macroscopique. Les cellules vont se libérer de la gaine si l'apport nutritif est faible. Linde montre en 1913 que ces gaines sont solubles dans 50 % de H2SO4, mais pas dans 5 %, ni 60 % KOH, ni des solutions de cuivre ammoniacal. Elles peuvent contenir de l'hémicellulose, mais ne réagissent pas comme la chitine (Linde, 1913; Zikes, 1915).
Dans les cultures (jeunes ou anciennes) certaines cellules engainées contiennent des corps réfringents de différentes tailles, parfois assez grandes cultures jeunes. Ils évoquent pour Stokes « des globules de graisse »[3], confondus selon lui par Zopf (1882), Eidam (1879), et Butsgen (1894) avec des spores, alors qu'ils n'avaient pas vérifié que ces granules résistaient à la chaleur.
Des trichomes existent, comme chez certaines cyanobactéries ou algues. De fausses ramification se produisent à partir du cytoplasme contigu de trichomes qui s'accolent entre eux et grandissent vers l'extérieur. En culture, les filaments jeunes semblent d'abord être de longues chaînes de protoplasma sans aucune subdivision. Avec le temps les filaments ressemblent à des des chaînes de bâtonnets reliées par des ponts mince de protoplasma. Puis les bâtonnées s'éloignent les uns des autres et de grands espaces apparaissent entre les cellules individuelles et des groupes de cellules alors que les cellules en bâtonnets commencent à sortir de la gaine. Plus souvent, et en laboratoire - selon Stokes qui note que dans la nature, en milieux ferrugineux, les choses pourraient se passer différemment - ce sont les gaines qui se désintègrent pour libérer leurs cellules, peut-être sous l'action d'enzymes sécrétées par les cellules[3].Forme en cellules individuelles motile : Les gaines semblent pouvoir être dissoutes par des enzymes cellulaires, et alors libérer des cellules libres, très mobiles, grâce à un unique faisceau de flagelles.
Ces flagelles sont au nombre de 5 à 8, et jusqu'à 12 voire 20 selon Stokes[3], mais parfois avec moins de brins, voire un seul cil selon Pringsheim. Les brins sont ondulés, d'épaisseur uniforme (0,2µm environ) et s'affinant sur leur partie terminale. Il est difficile de les compter, car ils tendent à se coller ensemble[3]). Les cellules se déplaçant hors de la gaine, Stokes suppose que les flagelles se forment quand les cellules y étaient encore enfermés, bien qu'ils soient alors rarement visibles au microscope).La longueur des flagelles est de 80 à 90 µm long (4 à 5 fois la longueur de la cellule[3]).
Ces flagelle apparaissent sur un locus externe de la paroi cellulaire, souvent près de l'extrémité arrondie, mais rarement à l'extrémité même, à moins qu'il ne s'agisse d'un effet optique dû au fait que les flagelles seraient collés sur la membrane externe de la bactérie[3]. Toutes les cellules de S. natans libres, nageant dans l'eau, présentent cette polarité[32]. Un organelle polaires au niveau du pôle multi-flagellé, près de la membrane cytoplasmique et à proximité du flagelle (Lybarger et Maddock, 2001). Les cellules immobiles ne possèdent pas cet organelle.
Ces cellules peuvent donner naissance à d'autres bactéries libres ou à des groupes de cellules « engainées ».Reproduction
La bactérie se reproduit par fission binaire (une bactérie en donne deux en se divisant). De fausses ramification se produisent parfois donnant un aspect branchu à la bactérie[33].
Ces micro-organismes nécessitent pour se développer et se reproduire une eau riche en fer, ou une eau eutrophe ou dystrophe riche en sucre, en azote et phosphore, ainsi que probablement d'autres oligo-éléments, dont un peu de calcium.
Le pH optimal est neutre à légèrement basique, mais en laboratoire, les souches testées croissaient à un pH compris entre 5,5 et 8,0. La bactérie a néanmoins été signalée dans des eaux ferrugineuses de drainage minier acide.Impacts économiques
Cette bactérie est connue d'une partie du monde industriel[34], pour causer des problèmes[35] tels que le colmatage de canalisations, crépines ou de filtres (même dans des systèmes dits inencrassables ou auto-nettoyants, en raison d'une part de sa capacité à former d'épaisses fillasses de bactéries enchevêtrées, et d'autre part à former des films très adhésifs en collant l'extrémité de ses filaments sur divers substrats, même lisses (verre, inox, PVC...) [34]. Pour ces raisons, elle a pu provoquer des dysfonctionnement (localement graves) dans certaines stations d'épuration d'eaux résiduaires (de papeteries et cartonneries notamment) [36].
Thermorésistance, antibiorésistances ou résistances aux biocides
Dans les années 1980 et 1990 dans différents pays, des isolats de souches mutantes ou inhabituelles de bactéries filamenteuses ont ainsi été trouvées dans des boues de papeterie et en aval de stations d'épuration.
Elles présentaient des caractéristiques morphologiques et physiologiques habituelles de Sphaerotilus, mais se reproduisant abondamment à des températures atteignant 40 ° C, soit bien plus que ce que peut normalement supporter Sphaerotilus natans.
Il est probable que ces souches plus résistantes aient été créées et sélectionnées par certains process industriels, qui utilisent une eau chaude, en partie recyclée en boucle (pour des raisons d'économie d'eau), et riches en nutriments appréciés par cette bactérie (sucres notamment).
Certaines souches ont également développé des résistances aux biocides présents dans la pâte à papier ou utilisés pour désinfecter les circuits (biocides chlorés par exemple[37]) afin d'y limiter les biofilms ou l'odeur que la fermentation bactérienne peut donner au papier. On a donc cherché d'autres moyens de la contrôler tout au long du process papetier[38], soit en modifiant le process, soit en trouvant de nouveaux moyens de la détruire (ozonation, température plus élevée, enzymes...).Des chercheurs japonais[39] ont trouvé des micro-organismes du sol et de cours d'eau capables, en laboratoire, de dégrader la gaine purifié de natans Sphaerotilus et de s'y développer.
Deux souches bactériennes nommées TB et TK, en forme de bâtonnet, anaérobie facultatives, dont l'endospore a une forme ellipsoïdale, non-colorées par coloration de Gram (ce qui laisse penser qu'elles pourraient appartenir au genre Paenibacillus) produisent un enzyme qui dégrade la gaine des sphaerotylus. Cette lyse de l'enveloppe protectrice de la bactérie est optimale à un pH compris entre 6,5 à 7,0 et à une température de 30 à 40°C [39].- Les ions Mg2 +, Ca2 +, Fe3 +, et l'iodoacétamide accélèrent cette dégradation, alors que les ions Cu2 +, Mn2 + et le dithiothréitol l'inhibent[39].
- L'enzyme elle-même agit sur la partie polysaccharidique de la gaine, produisant un oligosaccharide d'une taille intermédiaire entre celle des maltopentaoses et des maltohexaose[39].
Voir aussi
Articles connexes
Liens externes
- (fr)
Listes de liens externes
Bibliographie
- Pellegrin, Veronique, Stefan Juretschko, Michael Wagner, and Gilles Cottenceau. 1999. "Morphological and biochemical properties of a Sphaerotilus sp. isolated from paper mill slimes." Appl Environ Microbiol, vol. 65, no. 1. American Society for Microbiology. (156-162)
- Dias, F. F., N. C. Dondero, and M. S. Finstein. 1968. Attached growth of Sphaerotilus and mixed population in continuous-flow apparatus. Appl. Microbiol. 16:1191-1199 Résumé Medline.
- Stokes, J. L. 1954. Studies on the filamentous sheathed iron bacterium Sphaerotilus natans. J. Bacteriol. 67:278-291 (Texte complet).
Références
Références taxonomiques
- Mulder, E. G. 1989. Genus Sphaerotilus Kützing 1833, 386AL, p. 1994-1998. In J. G. Holt, et al. (ed.), Bergey's manual of determinative bacteriology, 8e éd. The Williams & Wilkins Co., Baltimore, Md.
- SKERMAN (V.B.D.), McGOWAN (V.) et SNEATH (P.H.A.) (editors): Approved Lists of Bacterial Names. Int. J. Syst. Bacteriol., 1980, 30, 225-420 (Approved Lists of Bacterial Names in IJSEM Online - Approved Lists of Bacterial Names Amended edition).
- [KÜTZING (F.T.): Beitrag zur Kenntnis über die Entstehung und Metamorphose der niedern vegetabilischen Organismen, nebst einer systematischen Zusammenstellung der hierher gehörigen niedern Algenformen. Linnaea, 1833, 8, 335-387.]
Notes et autres références
- Pringsheim, E. G. 1949 Iron bacteria. Biol. Revs., 24, 200-245.
- Pringsheim, E. G. 1949 The filamentous bacteria Sphaerotilus, Leptothrix, Cladothrix, and their relation to iron and manganese. Trans. Roy. Soc. (Londres), Series B, 233, 453-482.
- Stokes, J. L. 1954. Studies on the filamentous sheathed iron bacterium Sphaerotilus natans. J. Bacteriol. 67:278-291 (Texte complet).
- Sphaerotilus sur MicrobeWiki
- Mulder, E. G., and M. H. Deinema. 1992. The sheathed bacteria, p. 2612-2624. In A. Balows, H. G. Trüpper, M. Dworkin, W. Harder, and K. H. Schleifer (ed.), The prokaryotes. Springer-Verlag, Berlin, Germany.
- Büsgen, M. 1894 Kulturversuche mit Cladothrix dichotoma. Ber. deut. botan. Ges., 12, 147-152.
- Richard, M., O. Hao, and D. Jenkins. 1985. Growth kinetics of Sphaerotilus species and their significance in activated sludge bulking ; J. Water Pollut. Control Fed. 57:68-81
- Safade, T. L. 1988. Tackling the slime problem in a paper-mill. Paper Technol. Ind. 1988:280-285
- Gray, N. F. 1990. Activated Sludge. Oxford University Press. New York, NY. p.212
- Jenkins, David, M.G. Richard, G.T. Daigger. 1999. Manual on the Causes and Control of Activated Sludge Bulking and Foaming. Second Edition. Lewis Publishers. Chelsea, Michigan. 46,118,80pp
- Eikelboom, D. H. 1975. Filamentous organisms observed in activated sludge. Water Res. 9:365-388.
- Farquhar, G. J., and W. C. Boyle. 1971. Occurrence of filamentous microorganisms in activated sludge. J. Water Pollut. Control Fed. 43:604-622 (Résumé Medline).
- M. S. 1939 Estudio fisi6logico y sistematico de algunas Chlamydobacteriales. Thesis, Buenos Aires.
- LINDE, P. 1913 Zur Kenntnis von Cladothrix dichotoma Cohn. Centr. Bakteriol. Parasitenk., II Abt., 39, 369-394.
- Dias FF, Dondero NA, Finstein MS. ; Attached growth of Sphaerotilus and mixed populations in a continuous-flow apparatus ; Appl Microbiol. 1968 Aug;16(8):1191-9.
- Cas practic : Edar de Figueres, PDF, 25p, en espagnol
- Väisänen, O. M., E.-L. Nurmiaho-Lassila, S. A. Marmo, and M. S. Salkinoja-Salonen. 1994. Structure and composition of biological slimes on paper and board machines. Appl. Environ. Microbiol. 60:641-653 Article complet.
- Michael Allaby. "Sphaerotilus." A Dictionary of Plant Sciences. 1998. Consulté 2011/02/03, repris par Encyclopedia.com
- Denner, E. B. M., Kolari, M., Hoornstra, D., Tsitko, I., Kampfer, P., Busse, H.-J., Salkinoja-Salonen, M. (2006). Rubellimicrobium thermophilum gen. nov., sp. nov., a red-pigmented, moderately thermophilic bacterium isolated from coloured slime deposits in paper machines. Int. J. Syst. Evol. Microbiol. 56: 1355-1362 (Résumé et Texte complet)
- Hugues-van Kregten, H. C. 1988. Slime flora of New Zealand paper mills. Appita J. 41:470-474.
- Harju-Jeanty, P., and P. Väätänen. 1984. Detrimental micro-organisms in paper and cardboard mills. Pap. Puu. 3:245-259. (Fihe INIST/CNRS)
- Bernard Ferry, [Part des transformations naturelles et provoquées dans la nappe de la craie du nord de la France], Diplôme d'études approfondies de génie civil. USTL, Sept 1992, 11 pages, PDF
- Spring, S., P. Kämpfer, W. Ludwig, and K.-H. Schleifer. 1996. Polyphasic characterization of the genus Leptothrix: new descriptions of Leptothrix mobilis sp. Nov. and Leptothrix discophora sp. Nov. nom. Rev. And emended description of Leptothrix cholodnii emend. Syst. Appl. Microbiol. 19:634-643.
- Complément illustré
- van Veen, W. L., E. G. Mulder, and M. H. Deinema. 1978. The Sphaerotilus-Leptothrix group of bacteria. Microbiol. Rev. 42:329-356 (Article complet).
- Sphaerotilus natans partial 16S rRNA gene, type strain DSM 6575T GenBank: FR749902.1
- Siering, P. L., and W. C. Ghiorse. 1996. Phylogeny of the Sphaerotilus-Leptothrix group inferred from morphological comparison, genomic fingerprinting, and 16S ribosomal DNA sequence analyses. Int. J. Syst. Bacteriol. 46:173-182résumé et texte complet.
- Corstjens, P., et G. Muyzer. 1993. Phylogenetic analysis of the metal-oxidizing bacteria Leptothrix discophora and Sphaerotilus natans using 16S rDNA sequencing data. Syst. Appl. Microbiol. 16:219-223
- Takeda, Minoru, F. Nakano, T. Nagase, K. Iohara, J. Koizumi. 1998. Isolation and Chemical Composition of the Sheath of Sphaerotilus natans. Bioscience, Biotechnology, and Biochemistry, 62, 1138-1143.
- Voir illustration n° 8 de l'article de Stokes (p 4/14 de la version pdf)
- Gaudy, E., et R. S. Wolfe. 1962. Composition of an extracellular polysaccharide produced by Sphaerotilus natans. Appl. Microbiol. 10:200-205 (Résumé Medline).
- Lybarger, Suzanne R. et Janine R. Maddock. 2001. "Polarity in action: Asymmetric protein localization in bacteria." J Bacteriol, vol. 183, no. 11. American Society for Microbiology. (3261-3267)
- Leslie Peverall ; Page sur Sphaerotilus, BIOL/CSES 4684, consultée 2011/03/02
- Pellegrin, Veronique, Stefan Juretschko, Michael Wagner, and Gilles Cottenceau. 1999. "Morphological and biochemical properties of a Sphaerotilus sp. isolated from paper mill slimes." Appl Environ Microbiol, vol. 65, no. 1. American Society for Microbiology. (156-162)
- Mulder, E. G. 1964. Iron bacteria, particularly those of the Sphaerotilus-Leptothrix group, and industrial problems. J. Appl. Bacteriol. 27:151-173.
- Blanco, M. A., C. Negro, I. Gaspar, and J. Tijero. 1996. Slime problems in the paper and board industry. Appl. Microbiol. Biotechnol. 46:203-208
- Bennett, C. 1988. The control of microbiological problems in the paper industry. Int. Biodeterior. 24:381-386.
- Purvis, M. R., et J. L. Tomlin. 1991. Microbiological growth and control in the papermaking process. TAPPI Chem. Processing Aids 1991:69-77.
- Takeda, Minoru, Keishi Iohara, Sachie Shinmaru, Ichiro Suzuki, et Jun-Ichi Koizumi. 2000. "Purification and properties of an enzyme capable of degrading the sheath of Sphaerotilus natans." Applied and Environmental Microbiology, vol. 66, no. 11. American Society for Microbiology. (4998-5004)
Wikimedia Foundation. 2010.

