- Mutagène X
-
Mutagène X 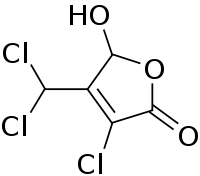
Général Nom IUPAC 3-chloro-4-(dichlorométhyl)-5-hydroxyfuran-2(5H)-one No CAS PubChem SMILES InChI Propriétés chimiques Formule brute C5H3Cl3O3 [Isomères] Masse molaire[1] 217,435 ± 0,011 g·mol-1
C 27,62 %, H 1,39 %, Cl 48,91 %, O 22,07 %,Écotoxicologie DL50 120 mg·kg-1 (souris, oral)[2] Unités du SI & CNTP, sauf indication contraire. La 3-chloro-4-(dichlorométhyl)-5-hydroxy-2(5H)-furanone ou communément appelé le Mutagène X (MX) est un sous produit provenant de la désinfection de l’eau par chloration. Le MX est produit lorsque le chlore réagit avec l’acide humique contenu dans l’eau usée. Le MX constitue un contaminant majeur responsable de près de 63-67 % du taux total de mutagénicité contenue dans l’eau potable chlorifiée de certains pays[3].
Certaines expériences[4] confirment que le Mutagène X cause l’apparition de tumeurs cancéreuses chez les souris. De plus, des tests faits in vitro et in vivo[5] démontrent que le MX génère des effets génotoxiques sur les cellules de souris. Le Mutagène X est aussi capable de détruire l’ADN des souris en induisant un stress oxydatif des cellules. Ainsi, certains[4] émettent l’hypothèse que le MX, présent dans l’eau potable chlorifiée, augmente les risques de développer le cancer chez l’humain. Le centre international de recherche sur le cancer (IARC) a désigné le MX comme étant un carcinogène de groupe 2B, signifiant que le Mutagène X est potentiellement cancérigène pour l’homme. Puisque ce contaminant présente un enjeu important pour la santé de l’homme, des méthodes analytiques fiables doivent être développées afin de quantifier et de suivre efficacement l’évolution du Mutagène X.
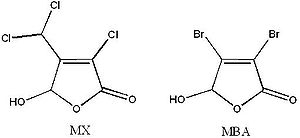
D’ailleurs, ce constituant est présent à de très faibles concentrations dans l’eau potable, allant de non détecté à 517 ng/L[3]. Donc, l’analyse du MX nécessite le développement d’une méthode analytique ayant une faible limite de détection de l’ordre du ng/L. La difficulté d’analyser le MX est aussi due à la sensibilité de ce dernier au pH ainsi qu’aux effets de matrice qui interfèrent lors de la dérivation et de l’analyse[3]. Le Mutagène X est sous forme de furanone à un pH inférieur à 2, tandis qu’à pH physiologique, il est sous forme de cycle ouvert (voir figure 1). Conséquemment, à bas pH le MX est très stable et possède un temps de demi-vie de près de 38 ans[4]. Par contre, plus le pH augmente, plus le Mutagène X se dégrade rapidement: a un pH de 7,8 le MX à un temps de demi-vie de 7 jours[4].
Donc, l’analyse de ce composé doit être faite à un pH inférieur à 2 afin d’être en mesure d’analyser qu’une seule forme du MX et d’éviter sa dégradation.
Sommaire
Analyse
Une des plus efficaces méthodes d’analyse pour doser le Mutagène X fut établie par Kubwabo, Stewart et Gauthier[3]. Ces derniers ont procédés à diverses techniques d’extractions, de pré concentrations, de dérivations et d’instrumentations afin d’optimiser la limite de détection et de quantification du MX.
Tout d’abord, dans plusieurs publications[3], l’analyse du Mutagène X est faite à l’aide d’un appareil GC-MS sur une colonne non polaire. Afin d’effectuer son analyse par GC, le MX doit subir une dérivation chimique de son groupement hydroxyle. Pour ce faire, la méthylation est un processus envisageable afin de rendre notre composé plus volatil. Par contre, la méthylation nécessite d’effectuer de nombreuses manipulations ce qui peut générer des pertes d’analytes. De plus, le MX méthylé ne permet pas une bonne détermination de ses fragments en mode SIM, ceci étant dû à des effets de matrices ce qui nuit à l’obtention d’une bonne limite de détection.
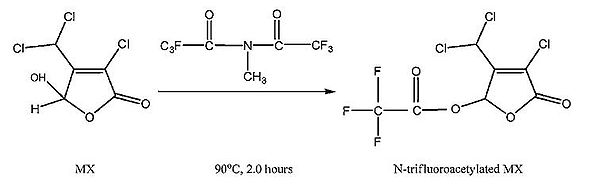
Ainsi, Kubwabo et al.[3] suggère une dérivation par acétylation faite avec du N-méthyl-bis-trifluoroacétamide ou communément appelé le MBTFA. En effet, le MBTFA a une très forte affinité pour les groupements hydroxyles. Il réagit fortement avec le Mutagène X (figure 2). De plus, les produits de dérivations du MBTFA sont reconnus[3] pour être très volatils donc efficace pour une analyse GC.
Extraction et dérivation
Avant d’effectuer la dérivation, il faut être en mesure d’effectuer l’extraction de notre contaminant. Pour ce faire, un tandem de phase solide d’extraction (SPE) composé d’une cartouche C18 et d’une cartouche Oasis HLB est utilisé. La cartouche C18 sert essentiellement à retenir toutes les substances hydrophobes très chargées en carbone contenu dans l’eau potable, par exemple : l’acide humique. Par ailleurs, le Mutagène X n’est pas retenu par la cartouche C18. Par la suite, l’extraction se poursuit dans une cartouche Oasis qui est composé d’un sorbant de copolymères ayant des propriétés hydrophobes et hydrophiles leur permettant de retenir à la fois des composés polaires et non polaires.
Puisque le MX est une molécule relativement polaire, la cartouche HLB sera en mesure de la retenir. Le conditionnement de la cartouche C18 et HLB s’effectue avec de l’acétone, du méthanol et de l’eau Super Q à pH 2. Un échantillon d’eau du robinet est ensuite chargé dans le tandem SPE à un débit de 10 mL/min. Puis, la cartouche HLB est séchée par jet d’air pour ensuite être éluée par un volume d’acétone. L’extractant est séché à 30 °C sous un léger jet d’azote jusqu’à l’obtention d’un volume de près de 2 mL. L’extractant est alors transféré dans un vial à GC, puis séché entièrement à l’azote. Une fois que l’échantillon est sec ce dernier est dérivé par l’ajout du solvant méthyl tert-butyl éther (MTBE) et de MBTFA. Puis, le vial est scellé puis inséré dans un vortex pour quelques minutes et incubé à 90 °C pour 2 heures. Une fois le temps de chauffage complété, le vial est refroidi à température ambiante et ensuite prêt pour analyse.
Étalonnage
L’étalonnage des solutions d’eau potable chlorée peut s’effectuer par calibration interne ou par ajouts dosés pour des concentrations de l’ordre du ng/L. Selon la méthode des ajouts dosés, l’insertion du standard MX et de l’étalon interne s’effectue avant l’extraction par le tandem C18/HLB.
D’ailleurs, l’étalon interne le plus efficace pour quantifier le Mutagène X est l’acide mucobromique (MBA). En effet, ce dernier possède une structure cyclique similaire (figure 3) au Mutagène X et qui est aussi dépendante du pH. De plus, le MBA réagit très bien avec le MBTFA et est retenu efficacement par la cartouche HLB.
Méthode d'analyse
L’analyse des divers échantillons peut s’effectuer à l’aide d’un chromatogramme à phase gazeuse couplé à un spectromètre de masse en tandem à trappe ionique (GC/MS/MS). Un détecteur MS/MS donne une très bonne sensibilité et sélectivité ; ce qui permet d’obtenir une limite de détection de l’ordre du ng/L (nécessaire pour la quantification du MX). La transition de masse utilisée pour la quantification du MX en tandem MS est de 199 m/z → 171 m/z.
Kubwabo et al.[3] ont obtenu pour le Mutagène X une limite de détection de la méthode (MDL) de 7,7 ng/L, une limite de quantification (LOQ) de 24,4 ng/L et une limite de détection pour l’instrument (IDL) de 1,9 ng/L. Ils ont établi que le pourcentage de récupération moyen de leur méthode d’analyse était de 124 % ce qui démontre l’efficacité de leur méthodologie.
Concentration du Mutagène X dans divers pays
Le Mutagène X a été détecté dans l’eau potable de nombreux pays, notamment : l’Australie, le Brésil, le Canada, la Chine, la Finlande, le Japon, la Norvège, la Pologne, la Russie, l’Espagne, l’Angleterre et les États-Unis. Les concentrations en Mutagène X mesurées dans différentes usines de traitements de l’eau par le chlore de certains pays sont donnés ci-dessous.
Concentration en mutagène X dans différents pays Pays Concentration en MX (ng/L) Canada 30 à 60 Chine 7.5 à 25 Russie 160 Espagne ND à 30 Finlande 15 à 67 États-Unis 13 à 180 Japon ND à 134 Australie ND à 33 ND = non déterminé
Notons qu’il y a des exceptions d’usines de traitements de l’eau où des concentrations élevées de Mutagène X ont été mesurées, notamment en Russie (586 ng/L) et aux États-Unis (850 ng/L).
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) « 3-Chloro-4-(dichloromethyl)-5-hydroxy-2(5H)-furanone » sur ChemIDplus, consulté le 17 mars 2010
- Kubwabo C., Stewart B., Gauthier S.A., Gauthier B.R., Analytica Chemica Acta, 2009, 649, 222-229.
- McDonald T.A., Komulainen H., Journal of Environmental Science and Health Part C, 2005, 23, 163-214.
- Yuan J., Liu H., Zhou L.H., Zou Y.L., Lu W.Q., Mutation Research, 2006, 609, 129-136.
Wikimedia Foundation. 2010.