- 2,4-dinitrophénol
-
2,4-dinitrophénol 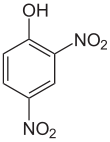
Structure du 2,4-dinitrophénolGénéral Nom IUPAC 2,4-dinitrophénol Synonymes 1-hydroxy-2,4-dinitrobenzène
DNPNo CAS No EINECS DrugBank PubChem ChEBI SMILES InChI Propriétés chimiques Formule brute C6H4N2O5 [Isomères] Masse molaire[2] 184,1064 ± 0,007 g·mol-1
C 39,14 %, H 2,19 %, N 15,22 %, O 43,45 %,pKa 4.09 à 25 °C[1] Propriétés physiques T° fusion 115 °C[3] T° ébullition 113 °C[4] Solubilité 2,79 g·l-1 (eau,20 °C)[1] Masse volumique 1,68 g·cm-3[4] T° d'auto-inflammation [4] Thermochimie ΔfH0solide -235,5 kJ·mol-1[3] ΔfusH° 24,174 kJ·mol-1 à 114,85 °C[3] PCI -2 697,2 kJ·mol-1[3] Précautions Directive 67/548/EEC 
T
NPhrases R : 23/24/25, 33, 50, Phrases S : (1/2), 28, 37, 45, 61, Transport 46 1320 SIMDUT[5] Produit non classifié SGH[6] 


DangerUnités du SI & CNTP, sauf indication contraire. Le 2,4-dinitrophénol (DNP) est un composé chimique aromatique de formule C6H4N2O5. C'est l'un de six isomères du dinitrophénol.
C'est un poison du métabolisme cellulaire. Il découple la phosphorylation oxydative en transportant les protons à travers la membrane mitochondriale, ce qui conduit à une augmentation rapide de la consommation d’oxygène en parallèle d'une faible formation d’ ATP.
Sommaire
Propriétés chimiques
Le 2,4-dinitrophénol est un solide cristallin jaune, qui a une odeur douceâtre de moisi. Il est très volatil, il se sublime lorsqu'il est légèrement chauffé et dégage alors de la vapeur. Il est modérément soluble dans l'eau (ses sels de sodium sont des cristaux solubles dans l'eau), l’acétate d'éthyle, l’acétone, le chloroforme, la pyridine, le tétrachlorure de carbone, le toluène, l’éthanol, le benzène, et les solutions aqueuses alcalines (Merck, 1989). Il forme des sels explosifs avec les produits alcalins et l’ammoniaque, et émet des fumées toxiques d'oxydes d'azote quand il est chauffé jusqu'à décomposition (Sax, 1989). Il est incompatible avec les métaux lourds et de leurs composés.
Synthèse
Usages industriels
Le 2,4-dinitrophénol est utilisé commercialement principalement dans la recherche scientifique et l'industrie manufacturière. Il a été utilisé à une époque pour fabriquer des colorants, d'autres produits utilisés en chimie organique et des produits de traitement des bois. Il a également été utilisé pour fabriquer des produits pour développer les photographies, des explosifs et des pesticides.
Utilisations dans la recherche
Le dinitrophénol est également utilisé pour identifier les cétones. Le DNP se combine avec les cétones et le point de fusion du composé qui en résulte permet de déterminer de quelle cétone il s’agit.
Action pharmacologique
Dans les cellules vivantes, le dinitrophénol agit comme un transporteur de protons (ionophores), un agent qui peut transporter les protons (ions hydrogène) à travers les membranes biologiques. Il contrarie le gradient des protons dans les mitochondries et les membranes des chloroplastes et provoque l'effondrement du gradient électrochimique que la cellule utilise pour produire l’énergie chimique de la plupart des molécules d’ATP. Au lieu de produire de l'ATP, l'énergie du gradient de protons est perdue en chaleur. Les cellules compensent la baisse du rendement de l'ATP en oxydant davantage les réserves stockées sous forme de glucides et de graisses.
Le dinitrophénol est souvent utilisé dans la recherche en biochimie pour explorer le fonctionnement de l’osmose chimique et des autres mécanismes protéiques de transport membranaire.
Toxicité pour l’environnement
Le dinitrophénol est considéré comme un important contaminant de l’environnement par l’Agence de protection de l'environnement des États-Unis (EPA). Il a été retrouvé dans 61 des 1 400 sites prioritaires qui on besoin d’être dépollués de leurs déchets industriels. Il peut contaminer l'atmosphère à partir des gaz d'échappement des véhicules automobiles, de la combustion de certaines substances industrielles, et de la réaction de l'azote de l'air atmosphérique avec d'autres produits chimiques. Le site majeur de dégradation est le sol, où il est métabolisé par les micro-organismes.
Mais les effets du dinitrophénol sur les micro-organismes anaérobies sont encore mal connus. Certaines études suggèrent qu’il existerait une toxicité pour les organismes anaérobies à cause de la réduction de la production de méthane.
Utilisation comme traitement amaigrissant
Le dinitrophénol a été largement utilisée dans les années 1930 dans les pilules amaigrissantes après que Cutting et Tainter de l'Université de Stanford aient réalisés leur première étude rapport sur la capacité des drogues d'accroître considérablement leur activité métabolique. Le dinitrophénol agit comme transporteur de protons dans la membrane mitochondriale, en inhibant la phosphorylation oxydative de l'ATP et en rendant la production d'énergie moins efficace. En effet, une partie de l'énergie qui est normalement produite à partir de la respiration cellulaire est gaspillée en chaleur. Ce manque d'efficacité est proportionnel à la dose de dinitrophénol qui est absorbée. Ainsi, lorsque la dose augmente, la production d'énergie devient moins efficace, le métabolisme est activé (davantage de matières grasses sont brûlées), afin de compenser l'inefficacité et répondre à la demande énergétique. Fait intéressant, le facteur qui limite le plus l’augmentation des doses de dinitrophénol n'est pas le manque de production d'énergie par l'ATP, mais plutôt une hausse excessive de la température corporelle due à la chaleur produite. En conséquence, une surdose de dinitrophénol va provoquer une fièvre fatale. Les effets secondaires dangereux et notamment les cataractes qui se sont développées ont abouti rapidement à l’interdiction du dinitrophénol aux États-Unis dans le courant de l’année 1938. Le dinitrophénol continue cependant à être utilisé par certains culturistes et athlètes pour perdre rapidement de la graisse corporelle. Les surdoses fatales sont rares, mais elles sont toujours signalées occasionnellement[7],[8]. En 2007, une allemande est décédée après avoir ingéré du DNP.
Alors que le dinitrophénol est considéré par beaucoup comme trop dangereux pour un usage humain, son mécanisme d'action reste l'objet d’étude comme approche d’un traitement potentiel de l'obésité[9]. Actuellement, la recherche est axée sur les protéines inhibitrices présentes naturellement chez l'homme.
Références
- (en) « 2,4-Dinitrophenol » sur ChemIDplus, consulté le 9 juillet 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) « Phenol, 2,4-dinitro- » sur NIST/WebBook, consulté le 9 juillet 2009
- 2, 4 - DINITROPHENOL HUMIDIFIE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- « Dinitro-2,4 phénol » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- McFee RB, Caraccio TR, McGuigan MA, Reynolds SA, Bellanger P, « Dying to be thin: a dinitrophenol related fatality », dans Veterinary and human toxicology, vol. 46, no 5, 2004, p. 251-4 [lien PMID]
- Miranda EJ, McIntyre IM, Parker DR, Gary RD, Logan BK, « Two deaths attributed to the use of 2,4-dinitrophenol », dans Journal of analytical toxicology, vol. 30, no 3, 2006, p. 219-22 [lien PMID]
- Harper JA, Dickinson K, Brand MD, « Mitochondrial uncoupling as a target for drug development for the treatment of obesity », dans Obesity reviews : an official journal of the International Association for the Study of Obesity, vol. 2, no 4, 2001, p. 255-65 [lien PMID]
Informations complémentaires
- Food Standards Agency (June 17, 2003). Food Standards Agency issues urgent advice on consumption of 'fat burner' capsules containing DNP. Communiqué de presse. Consulté le 2007-09-30.
Liens externes
- ToxFAQ about Dinitrophenols, Agency for Toxic Substances and Disease Registry, September 1996. Consulté le July 17, 2005
- General 2,4-dinitrophenol information.
- (fr) Fiche INRS
Catégories :- Produit chimique toxique
- Produit chimique dangereux pour l'environnement
- Dinitrophénol
Wikimedia Foundation. 2010.


