- Trinitrophénol
-
Acide picrique
Acide picrique 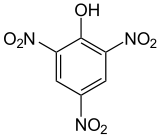
Structure de l'acide picrique Général Nom IUPAC 2,4,6-trinitrophénol Synonymes acide carbo-azotique
méliniteNo CAS No EINECS PubChem ChEBI SMILES InChI Apparence cristaux jaunes, inodores[1]. Propriétés chimiques Formule brute C6H3N3O7 [Isomères] Masse molaire 229,1039 g∙mol-1
C 31,45 %, H 1,32 %, N 18,34 %, O 48,88 %,pKa 0,38 Propriétés physiques T° fusion 121,9 °C [2] T° ébullition 300 °C (explosion) [3] Solubilité 14 g∙l-1 (eau,20 °C) [3] Masse volumique 1,76 g∙cm-3 à 20 °C [3] T° d’auto-inflammation 300 °C[1] Point d’éclair 150 °C[1] Thermochimie ΔfH0solide -217,9 kJ∙mol-1 [2] ΔfusH° 17,1 kJ∙mol-1 à 121 °C [2] Cp 239,7 J∙mol-1∙k-1 (solide,19,9 °C) [2] PCI -2 570,0 kJ∙mol-1 [2] Précautions Directive 67/548/EEC 
T
EPhrases R : 2, 4, 23/24/25, Phrases S : (1/2), 28, 35, 36/37, 45, Transport 40 1344
- 0154 NFPA 704 SIMDUT[4] 


SGH[5] 

DangerÉcotoxicologie DL50 200 mg/kg (rat, oral)
56,3 mg/kg (souris, i.p.) [6]LogP 1,64 [3] Unités du SI & CNTP, sauf indication contraire. L'acide picrique ou acide carbo-azotique (ou mélinite) est le terme commun pour le composé chimique 2,4,6-trinitrophénol,(NO2)3C6H2-OH.
Il a été découvert par Peter Woulfe en 1771 suite à l'action de l'acide nitrique sur l'indigo.
Welter l'obtint par action de l'acide nitrique sur de la soie, il fut de ce fait longtemps désigné sous le nom de "Jaune amer de Welter". C'est un solide cristallin jaune fabriqué à partir du chlorobenzène. C'est un composé très réactif (explosif, comme tous les composés hautement azotés, par exemple le trinitrotoluène ou la nitroglycérine), de puissance dépassant légèrement celle du TNT. Il attaque la plupart des métaux en produisant des picrates très instables et également explosifs (choc, friction, feu ou autre sources d'ignition).C'est un produit irritant pour la peau, les yeux et les voies respiratoires et toxique par inhalation, par contact avec la peau et/ou par ingestion.
Sommaire
Explosivité
La vitesse de détonation de l'acide picrique est de 7650 mètres/sec à sa densité maximale obtenue par compression. Sec, il est plus sensible aux chocs et aux frottements qu'additionné d'eau (on dit que l'eau le "flegmatise"), mais un peu moins que le TNT et beaucoup moins que l'hexogène ou la penthrite. C'est un des explosifs secondaires les plus stables. Il est encore plus stable s'il est recristallisé après fusion. Mais, pour des raisons de sécurité, son transport s'effectue sous forme humide (30% ou plus d'H2O), et les laboratoires qui l'utilisent le conservent également ainsi, toujours dans des contenants en verre (pas en cristal, qui contient du plomb, ni en métal, car cet acide peut former avec certains métaux, notamment le cuivre, des sels (picrates), explosifs et instables, particulièrement dangereux).
Caractéristique
- Peu soluble dans l'eau, l'éther, l'alcool ; soluble dans le benzène et l'acétone (propanone)
- Explose au dessus de 300 °C.
- Utilisations : explosifs, colorant, thérapeutique
- Risque majeur : explosion par choc, friction, feu
- voir l'article du wikilivre de tribologie.
- Il produit des sels (composés métalliques) explosifs très sensibles, des picrates...
- Couleur : jaunâtre
Classement de sécurité
Au Canada, il est classé comme "dangereusement réactif" au titre du classement SIMDUT (Système d'information sur les matières dangereuses utilisées au travail).
Utilisation
- Comme explosif (sous le nom de mélinite ou lyddite) : Alors que la houille dont on extrait son principe de base (le phénol) était abondante, l'acide picrique fut très utilisé durant la Première Guerre mondiale, surtout dans les obus dont le remplissage était facilité par un point de fusion relativement bas (122,5 °C) par rapport à sa température de décomposition (300 °C), assurant aux opérateurs une bonne marge de sécurité.
- Tests cutanés (autrefois).
- Colorant (teinture de la laine).(autrefois).
- Tannage des coussinets des pattes de lapins pour les rendre plus résistantes aux grillages de clapiers (autrefois).
- Colorant jaune vif pour le placage de bois, utilisé dilué (proportion de 1,5 à 3 pour 1000) sous forme de bain, souvent en combinaison avec le sulfate de fer (celui-ci sert d'accrocheur et donne une teinte gris-bleu) pour obtenir un vert vif notamment utilisé pour les pointes de trictrac (équivalent du jacquet ou backgammon au 18°siècle).
- De nos jours, l’acide picrique à faible dose est un des ingrédients du liquide de Bouin, un milieu de conservation utilisé pour les prélèvements en anatomo-pathologie.
- C'est un composant du réactif dosant la créatinine dans le sang par la méthode de Jaffé.
- C'est un remède efficace aux brûlures (mais peu utilisé en raison de son caractère dangereux(explosif).
Ecotoxicologie
Les impacts globaux de l'acide picrique sur l'environnement (champignons, flore, faune, bactéries..) ne semblent pas avoir été très étudiés. Cet acide est le principal explosif (mélinite) des millions d'obus non explosés de la première guerre mondiale, pour partie récupérées après guerre, mais souvent immergées en mer. Il est susceptible de contaminer l'environnement[7], au XXIe siècle quand ces obus seront suffisamment corrodés. Outre le risque toxique et écotoxique, existe un risque d'explosion suite à la formation de picrates. Or de l'acide picrique peut être présent dans des armes chimiques non explosées ou dans des munitions stockées à proximité de ces dernières.
Voir aussi
Liens internes
Lien externe
Notes et références
- ↑ a , b et c ACIDE PICRIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b , c , d et e (en) « 2,4,6-Trinitrophenol » sur NIST/WebBook, consulté le 28 août 2009
- ↑ a , b , c et d Entrée de « Picric acid » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 août 2009 (JavaScript nécessaire)
- ↑ « Acide picrique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ (en) « Picric acid » sur ChemIDplus, consulté le 28 août 2009
- ↑ Fiche Toxicologique INERIS du Chlorobenzène Voir page 11/20 (Version 2006 04 05)
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique explosif | Produit chimique corrosif | Explosif | Nitrophénol | Acide
Wikimedia Foundation. 2010.



