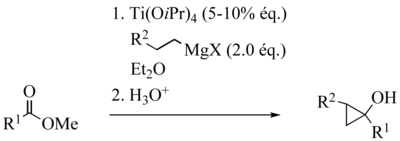- Reaction de Kulinkovich
-
Réaction de Kulinkovich
La réaction de Kulinkovich est une réaction de cyclopropanation des esters carboxyliques, conduisant diastéréosélectivement à des cyclopropanols.
Version stœchiométrique
Les premiers exemples de réactions de Kulinkovich, décrits en 1989, employaient une quantité stœchiométrique de tétraisopropyloxytitane. Trois équivalents de réactif de Grignard étaient nécessaires à l’obtention de bons rendements (1).
Version catalytique
C’est en 1991 que Kulinkovich démontra qu’une quantité catalytique de tétraisopropyloxytitane suffisait à l’obtention de bons rendements. Il s’avéra même possible, dans ces conditions, de réduire la quantité engagée de réactif de Grignard à deux équivalents (2).
Version asymétrique de la réaction de Kulinkovich
La réaction de Kulinkovich étant catalytique en titane, Corey et son équipe en publièrent une version asymétrique. Ils obtinrent des excès énantiomériques pouvant atteindre 78% en recourant à un ligand de type Taddol (3).
Mécanisme
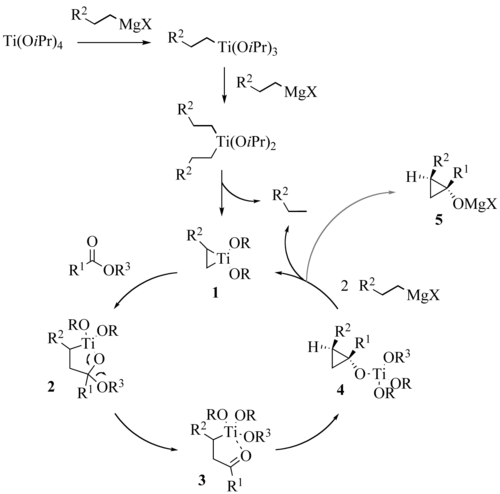
Le mécanisme couramment invoqué fait intervenir en premier lieu deux étapes succéssives de transmétallation de l’organomagnésien engagé, conduisant à un complexe dialkyldiisopropyloxytitane intermédiaire. Celui-ci subit une dismutation pour donner une molécule d’alcane et un titanacyclopropane 1. L’insertion du carbonyle de l’ester dans la liaison carbone-titane la plus dégagée de cette espèce conduit à un oxatitanacyclopentane 2 se réarrangeant en cétone 3. Enfin, l’insertion du groupe carbonyle de 3 dans la liaison carbone-titane résiduelle ferme le cyclopropane. Dans l’état de transition de cette étape élémentaire, qui est l’étape limitante de la réaction, une interaction agostique stabilisante entre l’hydrogène en α du groupement R² et l’atome de titane a été invoquée pour expliquer la diastéréosélectivité observée. Le complexe 4 obtenu est un tétraalkyloxytitane capable de jouer un rôle analogue à celui du tétraisopropyloxytitane de départ, ce qui clôt le cycle catalytique. En fin de réaction, le produit se trouve principalement sous la forme de l’alcoolate de magnésium 5, donnant le cyclopropanol au moment de l’hydrolyse du milieu réactionnel.
Le mécanisme de la réaction de Kulinkovich a fait l’objet de calculs approfondis publiés en 2001 (4). Certains points demeurent néanmoins obscurs et selon toute vraisemblance, le mécanisme de cette réaction n’est en réalité pas aussi simple. Des complexes de titane intermédiaires de type « ate » ont été récemment proposés par Kulinkovich (5).
Réactions d'échange de ligands avec des oléfines
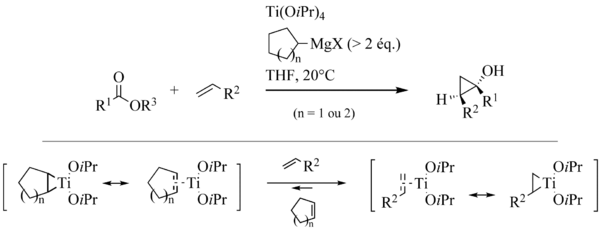
Dès 1993, l’équipe de Kulinkovich mit en évidence l’aptitude des titanacyclopropanes à subir des échanges de ligands avec les oléfines (6). Cette découverte était importante, car elle donnait accès à des cyclopropanols davantage fonctionnalisés en faisant l’économie de la préparation du magnésien correspondant, dont au moins deux équivalents auraient dû être engagés pour obtenir de bons rendements.
Cha et son équipe introduisirent l’emploi de réactifs de Grignard cycliques, particulièrement adaptés à ces réactions d’échange de ligands (7).
Réactions de Kulinkovich intramoléculaires
Une application intéressante des réactions d’échange de ligands consiste à réaliser des réactions intramoléculaires au départ d’esters portant une fonction oléfine (8).
Réactions apparentées
Plusieurs extensions de la réaction de Kulinkovich ont été développées :
- La réaction de Kulinkovich-de Meijere, conduisant à des aminocyclopropanes à partir d'amides.
- La réaction de Kulinkovich-Szymoniak, conduisant à des aminocyclopropanes à partir de nitriles.
- Voir aussi : F. Sato, H. Urabe et S. Okamoto, Pure Appl. Chem., 1999, 71, 1511-1519.
Sources d’informations complémentaires
Plusieurs articles récapitulatifs sont parus :
- O. G. Kulinkovich et A. de Meijere, Chem. Rev., 2000, 100, 2789-2834.
- F. Sato et al., Synlett, 2000, 753-775.
- A. de Meijere, S. I. Kozhushkov et A. I. Savchenko in Titanium and Zirconium in Organic Synthesis (Ed.: I. Marek), Wiley-VCH, Weinheim, 2002, pp 390-434.
- O.G. Kulinkovich, Chem. Rev., 2003, 103, 2597-2632.
- O.G. Kulinkovich, Russ. Chem. Bull., Int. Ed., 2004, 53, 1065-1086.
- O.G. Kulinkovich, Eur. J. Org. Chem., 2004, 4517-4529.
Pour un mode opératoire avec discussion, voir :
Références bibliographiques citées
(1) O. G. Kulinkovich, S. V. Sviridov, D. A. Vasilevsky et T. S. Prityckaja, Zh. Org. Khim., 1989, 25, 2244-2245.
(2) O. G. Kulinkovich, S. V. Sviridov et D. A. Vasilevski, Synthesis, 1991, 234.
(3) E. J. Corey, S. Achyutha Rao et Mark C. Noe, J. Am. Chem. Soc., 1994, 116, 9345-9346.
(4) Y.–D. Wu et Z.-X. Yu, J. Am. Chem. Soc., 2001, 123, 5777-5786.
(5) O. G. Kulinkovich et D. G. Kananovich, Eur. J. Org. Chem., 2007, 2121-2132.
(6) O. G. Kulinkovich, A. I. Savchenko, S. V. Sviridov et D. A. Vasilevski, Mendeleev Commun., 1993, 230-231.
(7) J. Lee, H. Kim et J. K. Cha, J. Am. Chem. Soc., 1996, 118, 4198-4199
(8) A. Kasatkin et F. Sato, Tetrahedron Lett., 1995, 36, 6079-6082.- Portail de la chimie
Catégories : Réaction formant une liaison carbone-carbone | Réaction organométallique
Wikimedia Foundation. 2010.