- R290
-
Propane
Propane
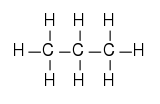
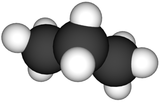
Structure 2D et 3D du propane Général Nom IUPAC propane Synonymes n-propane
diméthylméthaneNo CAS No EINECS PubChem SMILES InChI Apparence gaz comprimé liquefié, sans odeur, incolore.[1] Propriétés chimiques Formule brute C3H8 [Isomères] Masse molaire 44,0956 g∙mol-1
C 81,71 %, H 18,29 %,Propriétés physiques T° fusion -187,1 °C [2] T° ébullition -42,1 °C [2] Solubilité 75 mg∙l-1 (eau,20 °C) [2] Masse volumique 2,0098 kg∙m-3 (0 °C, 1015 mbar, gaz)
0,5812 kg∙l-1 (-42,1 °C, 1015 mbar, liquide) [2]T° d’auto-inflammation 470 °C [2] Point d’éclair -104 °C [2] Limites d’explosivité dans l’air 1,7 - 10,8 Vol.%
31 - 202 g/m-3 [2]Pression de vapeur saturante 8,327 bar à 20 °C
10,8 bar à 30 °C
17,081 bar à 50 °C [2]Point critique 369,9 °C, 42,5 bar, 0,2 l-1∙mol-1 [3] Point triple 1,685×10-9 bar à -188,1 °C [3] Thermochimie S0liquide, 1 bar 171,0 J∙mol-1∙K-1 [3] ΔfH0gaz -104,7 kJ∙mol-1 [3] ΔfH0liquide -119,8 kJ∙mol-1 [3] ΔvapH° 16,25 kJ∙mol-1 à 25 °C
18,774 kJ∙mol-1 à -42,1 °C [3]Cp 73,6 J∙mol-1∙K-1 (25 °C, gaz)
98,36 J∙mol-1∙K-1 (-43,1 °C, liquide) [3]PCS -2 195,9 kJ∙mol-1[4] PCI -2 028,37 kJ∙mol-1[4] Précautions Directive 67/548/EEC 
F+Phrases R : 12, Phrases S : (2), 9, 16, Transport 23 1978 NFPA 704 SIMDUT[5] 

SGH[6] 

DangerÉcotoxicologie LogP 2.36[1] Unités du SI & CNTP, sauf indication contraire. Le propane est un alcane linéaire de formule C3H8.
Il est dérivé d'autres produits pétroliers par des processus de thermochimie de gaz ou de pétrole. Il est couramment utilisé comme source d'énergie chimique par combustion dans les moteurs à combustion interne, barbecues et chaudières.
Généralement vendu à l'état liquide, sous forme de GPL notamment (c'est l'un de ses constituants principaux). Un additif, l'éthanethiol, est utilisé comme odorant pour signaler les fuites éventuelles.
Sommaire
Utilisation
La principale utilisation du propane est sa combustion. Il est le principale composant du gaz de pétrole liquéfié. Dans l'industrie, il est également utilisé comme réactif pour la production de l'éthylène et du propène au moyen du vapocraquage. Il est utilisé dans la synthèse du tétrachloroéthène et du tétrachlorométhane par chlorolyse. Et depuis peu la conversion par catalyse sur zéolyte permet la synthèse du benzène,du toluène et du xylène[7].
Propriétés physico-chimiques
Le propane est un gaz plus dense que l'air (1,5 fois) dans les conditions normales de température et de pression, il forme donc des poches au sol dans une pièce remplie d'air. Il se décompose à partir d'une température supérieure à 780 à 800 °C[2].
La combustion du propane est plus propre que celle de l'essence (grâce à son rapport H/C avantageux), mais plus polluante que celle du méthane ou de l'hydrogène. La présence de liaisons C-C crée des résidus organiques en plus de l'eau et du dioxyde de carbone. Ces produits rendent la flamme visible.
Production et synthèse
Le propane est principalement issu de la purification du gaz naturel ou extrait du gaz de pétrole liquéfié, une fraction du pétrole [7].
Ecologie
La Terre en libère une mégatonne par an dans l’atmosphère[8].
Notes et références
- ↑ a et b PROPANE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b , c , d , e , f , g , h et i Entrée de « Propane » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20 avril 2009 (JavaScript nécessaire)
- ↑ a , b , c , d , e , f et g Propane sur http://www.nist.gov/. Consulté le 20 avril 2009
- ↑ a et b Les gaz Butane Propane
- ↑ « Propane » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ a et b Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke, Ullmann's Encyclopedia of Industrial Chemistry, Hydrocarbons, Wiley-VCH Verlag GmbH & Co, 2000
- ↑ Science et Vie, On sait ce que la Terre dégaze d’hydrocarbures, nº 1098, mars 2009, p. 34.
- Portail de la chimie
- Portail de l’énergie
Catégories : Produit chimique extrêmement inflammable | Alcane linéaire | Gaz organique | Réfrigérant
Wikimedia Foundation. 2010.