- Pile électrique
-
 Différentes piles : deux piles de 9 volts, deux AAA, deux AA, une C, une D, une pour caméscope, une pour téléphone sans fil et une pour une radio amateur.
Différentes piles : deux piles de 9 volts, deux AAA, deux AA, une C, une D, une pour caméscope, une pour téléphone sans fil et une pour une radio amateur.
Une pile électrique (ou plus simplement pile) est un dispositif électrochimique transformant l'énergie d'une réaction chimique en énergie électrique. Dans une pile du commerce, les réactifs sont introduits à la fabrication. Quand ils sont épuisés, la tension s'effondre et on doit remplacer la pile usagée.
À l'origine, le terme désignait un élément unique composé d'un empilement d'une rondelle d'un métal et d'un autre baignant dans un électrolyte. Par extension, le mot « pile » désigne toute batterie monobloc non rechargeable. Cependant, le terme « batterie » désigne un ensemble d'éléments utilisés en série pour obtenir une tension souhaitée, dans un emballage unique. Une batterie peut être rechargeable ou non. Dans le langage courant, c'est généralement une batterie lorsqu'elle est rechargeable, notamment batterie de voiture, au plomb. Mais la locution « pile rechargeable » n'a pas de sens. De même, par abus de langage, le terme « pile » est utilisé pour désigner d'autres générateurs électrochimiques : pile à combustible, accumulateur électrique.
Sommaire
Principe
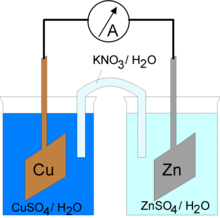
 Schéma d'une pile. Chaque récipient sert de demi-cellule. Dans chaque demi-cellule, une électrode (symbolisée par une brique) y est plongée. Les deux demi-cellules sont également reliées par un pont salin, lequel sert au maintien de l'équilibre des charges électriques. Ce pont permet le passage d'ions, mais pas celui du solvant. Lorsque les électrodes sont constituées de matériau présentant une différence de potentiel suffisante, un courant électrique s'établit de la cathode à l'anode, c'est-à-dire de l'électrode positive à l'électrode négative.
Schéma d'une pile. Chaque récipient sert de demi-cellule. Dans chaque demi-cellule, une électrode (symbolisée par une brique) y est plongée. Les deux demi-cellules sont également reliées par un pont salin, lequel sert au maintien de l'équilibre des charges électriques. Ce pont permet le passage d'ions, mais pas celui du solvant. Lorsque les électrodes sont constituées de matériau présentant une différence de potentiel suffisante, un courant électrique s'établit de la cathode à l'anode, c'est-à-dire de l'électrode positive à l'électrode négative.
Le boîtier d'une pile abrite une réaction chimique entre deux substances dont l’une peut céder facilement des électrons (matériau réducteur), et l’autre qui les absorbe (matériau oxydant). Chacune de ces réactions chimiques est dite « demi-réaction ». Lorsque qu'elles sont proprement combinées, elle forment une réaction d'oxydo-réduction. Chaque demi-réaction survient dans une solution où se produit un échange d'électrons. Ce sont ces électrons qui sont échangés entre les deux substances. Pour assurer l'équilibre des charges électriques, il faut relier les deux solutions à l'aide d'un pont salin, système qui permet le transport de certains ions tout en interdisant la circulation du solvant.
Chaque élément du couple oxydant/réducteur est relié à une électrode. Ces électrodes, lorsqu'elles sont reliées à un consommateur électrique, provoquent la circulation d'un courant électrique ; la réaction chimique provoque une circulation de charges (électrons, ions). Une pile fournit donc du courant continu. La borne (-) d'une pile correspond à l'anode où se produit la réaction d'oxydation qui va fournir les électrons. La borne (+) d'une pile correspond à la cathode où se produit la réaction de réduction qui va consommer les électrons.
Ce système est utilisé pour les piles électriques et les batteries d'accumulateurs, avec divers couples électrochimiques. Une pile électrique peut contenir plusieurs de ces couples montés en série, ce qui permet d'augmenter la tension disponible aux bornes de la pile.
Il est possible de réaliser une pile artisanale, par exemple en piquant dans un citron un trombone déplié ou un clou (en acier galvanisé, recouvert donc de zinc) et un fil électrique dénudé (en cuivre) reliés à une petite lampe ou une diode électroluminescente bien choisie[1]. On trouve dans le commerce des gadgets qui utilisent ce principe : par exemple des petites horloges à quartz qui sont alimentées par une pomme de terre.
Histoire
Il existe des objets archéologiques, comme ceux trouvés en 1936, ressemblant à des piles. C'est le cas de la pile électrique de Bagdad qui est datée entre 250 av. J.-C. et 250 mais elles pourraient être encore plus anciennes et expliqueraient le placage si parfait de nombreux bijoux antiques si légers. Elles auraient fonctionné aux jus de fruits voire au sulfate de cuivre, des expérimentations modernes ont validé la faisabilité des deux modèles. Il n'existe aucun lien historique entre ces objets et le développement des piles contemporaines d'autant que l'usage de celles-ci serait le placage de métaux précieux ce qui expliquerait son usage mineur, confidentiel voire associé à un usage de faussaire (voir Archimède et la couronne du roi Hiéron)[2],[3],[4].
En 1786, Luigi Galvani observe que les muscles d'une cuisse de grenouille se contractent lorsquelle est mise en contact avec des métaux, de la même manière que lorsqu'on la branche sur une machine électrostatique. Il découvre que la réaction est plus forte quand il utilise un instrument composé de deux métaux différents.
En opposition avec les travaux de Galvani (électricité d'origine animale), Alessandro Volta invente la première pile à colonne le 17 mars 1800[5] ; ces premiers systèmes étaient constitués d'un « empilement » de disques de deux métaux différents séparés par des disques de feutre, imbibés d'acide, d'où le nom de l'invention. La pression de la colonne sur les disques du bas provoque un assèchement des cylindres de feutre qui finissent par ne plus remplir leur office. Volta invente donc rapidement la pile à couronne, constituée d'empilements plus petits montés en série.
Quelques mois après l'invention de Volta, deux chimistes britanniques, William Nicholson (1753-1815) et Anthony Carlisle (1768-1840) utilisent la pile de Volta pour réaliser la première électrolyse artificielle (électrolyse de l'eau) le 2 mai 1800.
Dès 1802, William Cruickshank crée la pile à auge en disposant verticalement les lames de zinc et de cuivre dans un bac à parois isolantes rempli d'eau acidulée. Elle est beaucoup plus simple à produire que la pile de Volta.
-
La pile voltaïque, première pile électrique, inventée par Alessandro Volta, est composée d'une alternance de disques de cuivre et de zinc séparés par un tissu imbibé de saumure
Piles polarisables
Entre 1813 et 1815, William Hyde Wollaston développe la pile Wollaston dans laquelle l'électrode de cuivre entoure l'électrode de zinc. Cela permet de doubler la surface de l'électrode et de prolonger le fonctionnement de la pile. Ces premières piles souffrent en effet d'un défaut de fonctionnement : la polarisation.
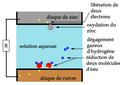
La réaction d'oxydo-réduction provoque une accumulation de sous-produits qui perturbe le fonctionnement de la pile. Dans ces piles zinc-cuivre c'est la réduction de l'acide de l'électrolyte qui produit un dégagement de bulles de dihydrogène sur le cuivre qui empêche le passage du courant. Au bout d'un certain temps, il est donc nécessaire de nettoyer la pile de ces dépôts pour qu'elle continue de fonctionner.
En 1813, Napoléon fournit à l'École polytechnique une pile voltaïque de 600 couples de cuivre et de zinc, occupant 54 mètres carrés de surface. Humphry Davy fait construire une pile Cruickshank constituée de 200 auges et de 2 000 couples à l'institut Royal de Londres. Avec ces piles monumentales il était possible d'obtenir des intensités de 10 ampères, soit des puissances de l'ordre de la dizaine de kW.
Piles impolarisables
Dans les piles impolarisables, les produits de la réaction d'oxydo-réduction utilisée n'altèrent pas les propriétés électrochimiques de l'ensemble.
En 1829, Antoine Becquerel crée la première pile à deux liquides séparés en enfermant la plaque de zinc en solution acide dans un gros intestin de bœuf, qui la sépare de l'électrode de cuivre placée dans un bain de sulfate de cuivre. La génération d'hydrogène est remplacée par une accumulation de cuivre sur les parois de la cathode.
Le principe est amélioré en 1836 par John Frederic Daniell qui remplace l'intestin de bœuf par un vase en terre poreuse. La pile Daniell est la première à offrir une source durable d'énergie. Le principe de la pile Daniell sera amélioré : plusieurs améliorations technologiques suivront, comme les piles Callaud qui seront utilisées par les compagnies de téléphone dans les années 1860.
Johann Christian Poggendorff invente en 1842 la pile à bichromate : elle dégage de l'oxygène qui se recombine avec l’hydrogène responsable de la polarisation. Créée en 1850, la pile Grenet est une pile à un seul liquide, avec des électrodes en charbon et en zinc amalgamé (plongé dans le mercure) dans un électrolyte d'acide sulfurique et de bichromate de potasse. Quand la pile n'était pas utilisée, il était nécessaire de retirer l'électrode en zinc de la solution pour la préserver. Diverses améliorations (pile Trouvé, pile Chardin, pile Voisin et Dronier…) vont suivre pour isoler cette électrode.
Ces piles bouteilles seront utilisées jusqu'au début du XXe siècle : la puissance et la tension élevée des piles au bichromate ont été longtemps appréciées au laboratoire. Elles ont été peu utilisées comme pile domestique à cause de la toxicité du bichromate et des problèmes d'entretien de l'électrode.
Piles à dépolarisation
Les piles à dépolarisation utilisent un réducteur pour éliminer les produits de réaction qui se forment à la cathode.
La première pile à dépolarisation est inventée en 1838 par William Robert Grove. Il remplace le cuivre par du platine et utilise de l'acide nitrique (nommé acide azotique à cette époque). Il obtient une pile puissante mais chère car le platine est un métal rare. En 1843 Robert Wilhelm Bunsen remplace le platine par du charbon ce qui réduit notablement les coûts. Mais la dépolarisation nitrique entraîne un dégagement de vapeurs toxiques qui rend l'emploi de ces piles malcommode.
En 1867, Georges Leclanché crée la première pile à dépolarisant solide : elle contient du dioxyde de manganèse. La pile Leclanché est moins puissante que la pile bouteille mais ne nécessite aucun entretien (elle « ne s'use que si l'on s'en sert » comme dira la publicité de la pile Wonder). En 1888, Carl Gassner invente la pile sèche en gélifiant la solution de chlorure d'ammonium avec de l'agar-agar. Avec quelques améliorations, cette pile sèche est toujours utilisée au XXIe siècle.
Samuel Ruben et Philip Mallory créent la pile au mercure pendant la Seconde Guerre mondiale. La première pile alcaline grand public sera conçue par Lewis Urry, Karl Kordesch et P.A Marsal en 1959 pour Union Carbide.
En 1970, les premières piles au lithium, qui permettent de remplacer le zinc par un métal plus réducteur, sont mises au point. Elles sont commercialisées en 1977.
Des piles ont été utilisées comme références pour définir une norme de tension avant d'être détrônée par une mesure basée sur l'effet Josephson : la pile Daniell, puis la cellule de Clark inventée en 1872 par Josiah Latimer Clark a été employée jusqu'en 1905, puis elle a été remplacée par la cellule de Weston jusqu'en 1972.
Piles de concentration
Il existe aussi ce qu'on appelle des piles de concentration qui sont des dispositifs électrochimiques comme les piles (deux solutions et un pont salin) qui tirent leur énergie de la différence de concentration d'un soluté d'une solution à l'autre. Les solutions et les anodes sont toutes de même type. C'est une méthode simple pour fabriquer de l'électricité. Ce modèle de pile intervient surtout dans l'industrie métallurgique au niveau de la galvanisation et de l'étude de la corrosion.
Classification
La plupart des cellules voltaïques sont limitées à 1,5 V, en raison des potentiels électrochimiques de leurs composants. Les cellules à base de lithium peuvent fournir des tensions plus élevées (jusqu'à 4,5 volts).
Par capacité
La capacité d'une pile est souvent exprimée en ampères-heures (1 Ah = 3 600 coulombs). Si une pile peut fournir un ampère (1 A) de courant pendant une heure, elle a une capacité de 1 Ah. Si elle peut fournir 1 A pendant 100 heures ou 2 A pendant 50 heures, etc., sa capacité est de 100 Ah. Elle est directement dépendante de la quantité d'électrolyte et d'électrode dans la pile.
Par format
Le format des piles électriques est normalisé par la Commission électrotechnique internationale (CEI) et par l'American National Standards Institute (ANSI). Bien que la norme CEI soit devenue un standard, un certain nombre d'appellations propres aux fabricants de piles subsiste.
Par technologie
Depuis décembre 1998, les piles au mercure sont interdites en Europe (directive 98/101/CE) et aux États-Unis pour des problèmes environnementaux. Il existe donc trois grandes technologies de piles grand public :
- Pile alcaline 1,5 V ( ⊝ Zn / Zn(OH)42- / K+ + OH- / MnO(OH) / MnO2 / C ⊕ ).
- Pile saline carbone-zinc 1,5 V. Pour des appareils à faibles besoins ( ⊝ Zn / Zn2+ / NH4+ + Cl- / MnO(OH) / MnO2 / C ⊕ ).
- Pile au lithium 1,5 V (appelée aussi L91), capable de maintenir très longtemps la tension électrique[6], et de fournir un courant élevé.
- On trouve aussi des piles à l'oxyde d'argent (certaines piles boutons pour montres) ou des piles zinc-air (utilisées notamment dans les prothèses auditives) (⊝ Zn / ZnO // Ag2O / Ag / C ⊕).
Capacité et décharge des piles
Plus il y a de matériau d'électrolyte et d'électrode dans la cellule, plus grande sera la capacité de la cellule. Donc, une petite cellule aura une capacité moindre qu'une grande, à technologie chimique comparée, parce qu'elle développent le même circuit ouvert de tension.
À cause des réactions chimiques dans les cellules, la capacité d'une pile dépend des conditions de décharge telle que l'intensité du courant (qui peut varier dans le temps), la tension de coupure de l'appareil utilisateur, la température et encore quelques facteurs[7].
La capacité théorique d'une pile, définie par les fabricants, est de 20 heures (le temps de décharge) multiplié par le courant que peut fournir la pile pendant cette durée. Elle est observée à 20 °C sur un équipement normalisé. Sa mention n'est pas obligatoire sur les emballages, et de fait, elle est très rarement mentionnée Une pile déclarée à 100 A·h donnera 5 A sur une période de 20 heures à la température normale d'une pièce. Par contre, si elle déjà déchargée à 50 Ah, c'est qu'elle a une capacité inférieure à ce qui est déclaré[8].La relation entre le courant, la décharge et la capacité pour une batterie au plomb est approximativement déterminée par la loi de Peukert modélisant la capacité d'une pile en fonction du courant débité.
où
- QP est la capacité de décharge à 1 ampère.
- I est le courant débité par la batterie en A.
- t est le temps que la batterie pourra tenir.
- k est une constante empirique de l'ordre de 1.3.
Pour les basses puissances, l'auto-décharge doit être intégrée.
En pratique, une batterie est plus efficace si elle est déchargée avec une basse intensité. Pour une pile qui a une auto-décharge relativement élevée, l'auto-décharge peut consommer la majorité de la capacité de la batterie. Précisons que toutes les piles se déchargent au cours du temps, même si elles ne sont pas utilisées. Il existe des technologies de piles activables qui permettent de retarder le démarrage de la réaction. Elles sont par exemple utilisées dans les éléments de sécurité (coussin gonflable, balise de détresse de bateau, etc.) ou dans certaines applications militaires. C'est aussi le cas des piles boutons zinc-air, il faut enlever la languette qui ferme l'élément avant de le mettre en service.
La valeur en ampères-heures n'est comparable que pour des tensions similaires. En courant continu, l'énergie est le multiple de l'intensité et du temps par la tension. On obtient donc 1 Wh ↔ 1 Ah x 1 V ↔ 1 A x 1 h x 1 V. Pour une même valeur en Ah, une pile de 3V peut fournir deux fois plus d'énergie qu'une pile de 1,5 V.
Par convention, on donne la capacité comme étant l'intensité qu'elle peut soutenir pendant dix heures jusqu'à 80 % de sa tension nominale. En effet, plus l'intensité est forte, plus rapide est la dépolarisation de la pile.
Utilisation
Beaucoup de piles sont utilisées par groupe de 2,3,4 ou 6, en série. La performance d'un assemblage de piles branchées en série est celle de son élément le plus faible. De plus, si un élément était moins chargé que les autres, il serait parcouru par un courant électrique à cause des autres piles (ce qui reviendrait à le charger à l'envers). La protection la plus efficace est la coupure du circuit lorsque la tension fournie par les piles descend en-dessous d'un certain seuil. Pour des raisons aisées à comprendre, les fabricants de piles recommandent de changer toutes les piles en même temps et le même modèle de pile.
En moyenne, les piles électriques sont jetées alors qu'elles possèdent encore un tiers d'énergie utilisable[9], et 1/10 serait encore presque neuve. En effet, les appareils électroniques (appareil photo numérique, lecteur MP3, etc.) ont besoin d'une tension minimale pour fonctionner. Or, la tension de l'ensemble baisse au cours de la décharge, mais à une vitesse différente selon l'élément. Les piles possédant encore une certaine capacité peuvent alors encore être utilisées pour alimenter des appareils moins exigeants (réveil, jouet, lampe de poche, télécommande, etc.).
D'un point de vue scientifique, Les couples redox des piles (à l'anode et à la cathode) sont partiellement réversibles. Les réactions chimiques inverses sont possibles. La chute de tension de la pile, qui se produit naturellement lors de la décharge, peut être inversée par l'injection d'un courant, qui va favoriser la réaction inverse. Ce qui explique que les piles alcalines peuvent être réutilisées jusqu'à plusieurs dizaines de fois moyennant certaines conditions : ne pas laisser chuter la tension sous 1,25V et ne pas recharger au-delà de 1,70 V sous un courant de C/10[10]. La recharge de pile au zinc est possible aussi mais plus aléatoire, le boitier en zinc ne se reconstituant pas[réf. souhaitée]. Cette pratique est déconseillée par les fabricants, qui avertissent d'un risque d'échauffement des piles, de leur explosion ou d'une fuite acide[11]. Il existe des appareils qui mettent en oeuvre la réversibilité partielle des réactions chimiques qui se produisent lors de la décharge des piles. Ces appareils permettent de réutiliser plusieurs fois les piles alcalines, et réduire le gaspillage actuel des piles alcalines.
Précisons que chauffer une pile ne la régénère pas. Mais le fait de la laisser au repos permet au dépolarisant d'agir, libérant la cathode des produits qui bloquent l'absorption des électrons[12].
Recyclage
Les piles sont des déchets à traiter avec précaution. Elles contiennent des métaux (nickel, cadmium, mercure, plomb, fer, zinc ou lithium) dont certains sont toxiques et nocifs pour l'environnement. En outre, les piles ne sont évidemment pas biodégradables.
Le principal danger direct pour l'homme, et de loin, est l'ingestion par les jeunes enfants. Si les constituants de la pile sont libérés dans le tube digestif, ils peuvent provoquer un empoisonnement. Les soins médicaux permettent généralement d'éviter le pire, mais on déplore malheureusement des décès chez les jeunes enfants. Il faut être extrêmement vigilant, notamment pour les piles de petite taille.
En date de 2009, les métaux lourds ont été éliminés de la plupart des piles vendues sur le marché. Ainsi les piles alcalines ne contiennent plus de métaux lourds (sauf à l'état de trace), la loi l'interdisant depuis des années. Certaines piles boutons en revanche contiennent encore du mercure qui est un métal lourd dangereux. La fabrication et la commercialisation des accumulateurs Ni-Cd, qui contiennent du cadmium, a été interdite, sauf dérogation.
Les piles ne doivent pas être jetées dans une poubelle ordinaire, mais doivent être amenées à un point de collecte (dans des magasins ou d'autres édifices publiques, comme des collèges, ou certaines entreprises).En effet elles contiennent des substances toxiques.
En France, les vendeurs qui commercialisent des piles et des batteries sont tenus de les reprendre gratuitement une fois usagées. Les piles doivent ensuite être valorisées ou éliminées. En Suisse, une taxe comprise dans le prix de vente finance le recyclage des piles. En Belgique, environ 70 % des piles étaient collectées en 2000. En France en 2006, près de 9 000 tonnes ont été collectées et recyclées selon l'Ademe[13].
Le recyclage permet de récupérer des métaux réutilisables (fer, manganèse, zinc et mercure principalement). Mais les piles ne sont pas recyclables à 100 %, et les scories résiduelles doivent être déposées dans des décharges.
Taux de recyclage en 1999 : 55 % contre 35 % en 1998 (nouveau procédé pour les piles salines et alcalines). Ce taux est basé sur le poids total brut des piles collectées. 15 % à 18 % du poids des piles est constitué d’eau.
Incinération (valorisation thermique) : 10 %
Marché
En 2004, 875 millions de piles ont été vendues en France (alcalines 75 %, salines 22 %, rechargeables 2 %)[14], 100 millions en Belgique en l'an 2000[13].
Parmi les fabricants de piles, on peut citer Duracell, Energizer, Sony, Rayovac, Varta, Philips, Panasonic, Saft, Kodak, etc.
Notes et références
- [PDF] Palais de la découverte, LA Pile au citron, IFIM23, 2006
- Magazine, Monde Inconnu (Le), No 84, 06/1987, Technologies avancées dans les temps reculés, Michel Granger}
- La pile de Bagdad
- Pile de Bagdad
- Publication soumise le 20 mars 1800 dans une lettre en français au président de la Royal Society, Joseph Banks
- Zinnikers Batterie und Akku Seiten : La pile idéale
- Battery Knowledge - AA Portable Power Corp.. Consulté le 16 avril 2007.
- Buchmann, Isidor. Discharge methods. Battery University. Consulté le 14 août 2008.
- La fausse mort des piles, brochure de la plate-forme d’information des cantons romands [PDF]
- Recharging the unchargeable, Michael Slifkin, Electronics World p320 27 avril 1998
- Manuel du chargeur de batterie SAMSUNG SLB1437
- http://www.uclouvain.be/cps/ucl/doc/emediasciences/documents/Les_piles(1).pdf Les Piles p20], Pierre Hautier et Jacques Koplowicz, CDESS
- Tout sur les piles en 27 questions
- Qui sont les champions... des piles - Le journal du Management, 26 avril 2006
Voir aussi
Articles connexes
- Accumulateur électrique
- Pile Daniell
- Pile au mercure
- Pile au lithium
- Pile thermique
- Format des piles et accumulateurs électriques
- Chargeur (électricité) Pour les batteries rechargeables
Liens externes
- La pile de Volta - Alessandro Volta, 1800
- Qualitionnaire - Définitions légales et normatives - Pile
- Portail de la chimie
- Portail de l’électricité et de l’électronique
-
Wikimedia Foundation. 2010.