- Phtalimide
-
Phtalimide 
Structure et représentation du phtalimide Général Nom IUPAC benzène-1,2-dicarboximide No CAS No EINECS SMILES InChI Apparence solide blanc Propriétés chimiques Formule brute C8H5NO2 Masse molaire[1] 147,1308 ± 0,0076 g·mol-1
C 65,31 %, H 3,43 %, N 9,52 %, O 21,75 %,pKa 8,3 Propriétés physiques T° fusion 238 °C [2] T° ébullition 336 °C (sublimation) Solubilité 360 mg·l-1 (eau, 25 °C)[2]
0,6 g·l-1 (eau) [3]Masse volumique 1,21 g·cm-3 à 20 °C [3] Point d’éclair 165 °C DIN 51758[3] Écotoxicologie LogP 1,15 [2] Composés apparentés Autres composés maleimide (amides) et anhydride phtalique Unités du SI & CNTP, sauf indication contraire. Le phtalimide est un imide aromatique, c'est-à-dire un composé organique avec deux groupements carbonyle liés à un atome d'azote trigonal. C'est l'imide de l'acide benzène-1,2-dicarboxylique (acide phtalique).
Sommaire
Propriétés
Le phtalimide est un solide blanc cristallisé à température ambiante. Il est pratiquement insoluble dans l'eau froide, très peu soluble dans le benzène et l'éther de pétrole, et assez soluble dans l'éthanol chaud, l'acide éthanoïque et les bases concentrées.
Obtention
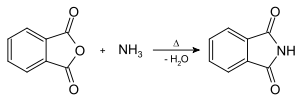
Le phtalimide est obtenu par réaction à chaud de l'anhydride phtalique avec l'ammoniac en solution aqueuse[4].
Réactivité
Réaction de Gabriel
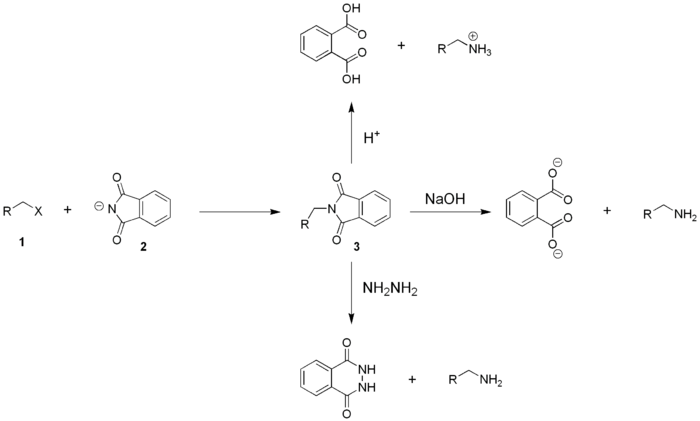
La principale réaction utilisant le phtalimide est la synthèse de Gabriel des amines primaires. Cette réaction porte le nom du chimiste allemand Siegmund Gabriel, qui l'a mise au point[5].
Cette réaction permet aussi de synthétiser des acides α-aminés à partir du phtalimide et de l'acide α-bromé correspondant :
Réarrangement d'Hofmann
L'action de l'ion hypochlorite en solution aqueuse conduit, par réarrangement d'Hofmann, à la formation de l'acide anthranilique, précurseur dans la synthèse de l'indigo.
Utilisations
Le phtalimide est utilisé comme produit phytopharmaceutique, en synthèse organique, en recherche et dans l'industrie des matières plastiques.
Dans la nature
La kladnoïte est un minéral naturel analogue au phtalimide. Il est assez rare, et se rencontre sur des sites d'incendie de charbon.
Références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) « Phthalimide » sur ChemIDplus, consulté le 29 juin 2009
- Entrée de « Phthalimide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 29 juin 2009 (JavaScript nécessaire)
- Arun Sethi, Systematic Lab Experiments in Organic Chemistry, 2003, éd. New Age International (ISBN 9788122414912), p. 659
- S. Gabriel, S. Ber. 20, 2224 (1887)
Vogel's Textbook of Practical Organic Chemistry (Longman).
Liens externes
Voir aussi
Wikimedia Foundation. 2010.