- Pentafluorure d'iode
-
Pentafluorure d'iode 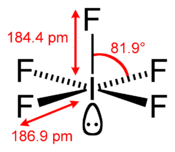

Structure du pentafluorure d'iodeGénéral No CAS No EINECS Propriétés chimiques Formule brute IF5 Masse molaire[1] 221,89649 ± 3,0E-5 g·mol-1
F 42,81 %, I 57,19 %,Propriétés physiques T° fusion 9,43 °C T° ébullition 100,5 °C à 101,3 kPa Solubilité S'hydrolyse en libérant HF Masse volumique 3 207 kg·m-3 Propriétés électroniques 1re énergie d'ionisation 12,943 ± 0,005 eV (gaz)[2] Unités du SI & CNTP, sauf indication contraire. Le pentafluorure d'iode est un composé chimique de formule IF5. C'est un liquide jaune pâle dense (3 210 kg·m-3) préparé pour la première fois par Henri Moissan en 1891 en faisant brûler de l'iode solide dans du fluor[3]. C'est toujours cette réaction exothermique qui est utilisée, bien que ses conditions aient été améliorées depuis[4],[5] :
- I2 + 5 F2 → 2 IF5
C'est un agent fluorant puissant et très oxydant. Il réagit violemment à l'eau en formant de l'acide fluorhydrique HF.
La molécule IF5 a une géométrie pyramidale carrée, que la théorie VSEPR permet bien d'expliquer :
-
- l'atome d'iode est au centre de la molécule
- l'un des atomes de fluor est lié à l'iode par une liaison covalente
- la position diamétralement opposée à cet atome de fluor est occupée par un doublet non liant de l'atome d'iode
- les quatre derniers atomes de fluor s'organisent en deux alignements F-I-F orthogonaux formant la base de la pyramide, chaque aligmement F-I-F permettant une liaison à trois centres et quatre électrons
Les cinq atomes de fluor sont donc liés à l'iode par des liaisons de type différent, ce qui se traduit par des longueurs de liaison différentes :
-
- ~ 184,4 pm pour la liaison I-F covalente
- ~ 186,9 pm pour les liaisons I-F impliquées dans une liaison 3c-4e
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- M. H. Moissan, « Nouvelles Recherches sur le Fluor », dans Annales de chimie et de physique, vol. 6, 1891, p. 224–282 [texte intégral]
- Otto Ruff, Keim R., « "Das Jod-7-fluorid" (The iodine-7-fluoride) », dans Zeitschrift für Anorganische un Allgemeine Chemie, vol. 193, no 1/2, 1930, p. 176–186 [lien DOI]
- Ruff O., Keim R., « Fluorierung von Verbindungen des Kohlenstoffs (Benzol und Tetrachlormethan mit Jod-5-fluorid, sowie Tetrachlormethan mit Fluor) », dans Zeitschrift für Anorganische un Allgemeine Chemie, vol. 201, no 1, 1931, p. 245–258 [lien DOI]
Article connexe
Wikimedia Foundation. 2010.
