IF7
- IF7
-
Heptafluorure d'iode
| Heptafluorure d'iode |
|
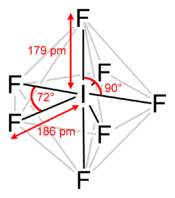
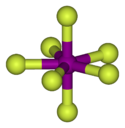 
Structure de l'heptafluorure d'iode |
| Général |
| No CAS |
16921-96-3 |
| No EINECS |
240-981-4 |
| Propriétés chimiques |
| Formule brute |
F7IIF7 |
| Masse molaire |
259,89329 g∙mol-1
F 51,17 %, I 48,83 %,
|
| Propriétés physiques |
| T° fusion |
4,5 °C à 101,3 kPa
Jusqu'à 6 °C sous pression |
| T° ébullition |
4,77 °C à 101,3 kPa |
| Masse volumique |
2 800 kg/m3 à 6 °C |
|
Unités du SI & CNTP, sauf indication contraire.
|
L'heptafluorure d'iode est le composé de formule IF7[1],[2]. Cette molécule a une géométrie bipyramidale pentagonale peu courante[3].
L'heptafluorure d'iode se présente sous forme d'un solide cristallin blanc qui fond à 4,5 °C mais bout dès 4,77 °C en formant une vapeur dense à l'odeur âcre de moisi. C'est un composé très irritant pour la peau et les muqueuses.
On le prépare en faisant barboter du fluor F2 dans du pentafluorure d'iode IF5 liquide à 90 °C puis en chauffant la vapeur à 270 °C. Une autre méthode, qui permet de limiter la formation d'IOF5 et des impuretés issues de l'hydrolyse, consiste à partir d'iodure de palladium PdI2 ou de potassium KI[4],[5].
Notes et références
- ↑ Macintyre, J. E. (Ed. 1992) Dictionary of Inorganic Compounds (Vol. 3), Chapman & Hall, Londres.
- ↑ O'Neil, Maryadele J. (Ed. 2001) The Merck Index (13th ed.), Merck, Whitehouse Station (New Jersey).
- ↑ K. O. Christe, E. C. Curtis, D. A. Dixon, « On the problem of heptacoordination: vibrational spectra, structure, and fluxionality of iodine heptafluoride », dans Industrial & Engineering Chemistry, vol. 115, no 4, 1993, p. 1520–1526 [lien DOI]
- ↑ W. C. Schumb, M. A. Lynch, Jr., « Iodine Heptafluoride », dans Industrial & Engineering Chemistry, vol. 42, no 7, 1950, p. 1383–1386 [lien DOI]
- ↑ Ruff O., Keim R., « "Das Jod-7-fluorid" (The iodine-7-fluoride) », dans Zeitschrift für Anorganische und Allgemeine Chemie, vol. 193, no 1/2, 1930, p. 176–186 [lien DOI]
Article connexe
 Portail de la chimie
Portail de la chimie
Catégories : Composé du fluor | Composé de l'iode
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article IF7 de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
IF7 — Strukturformel Allgemeines Name Iodheptafluorid Andere Namen Iod(VII) fluorid … Deutsch Wikipedia
Гептафторид иода — Общие Систематическое наименование Фторид иода (VII) Химическа … Википедия
Iodine heptafluoride — Chembox new Name = Iodine Heptafloride ImageFile = Iodine heptafluoride 2D dimensions.png ImageName = Structure of the iodine heptafluoride molecule ImageFileL1 = Iodine heptafluoride 3D balls.png ImageNameL1 = Iodine heptafluoride ImageFileR1 =… … Wikipedia
Фторид иода(VII) — Фторид иода(VII) … Википедия
Валентность (химич.) — Валентность (от лат. valentia ≈ сила), способность атома к образованию химических связей. Количественной мерой В. обычно принято считать число других атомов в молекуле, с которыми данный атом образует связи. В. ≈ одно из фундаментальных понятий… … Большая советская энциклопедия
Валентность — I Валентность (от лат. valentia сила) способность атома к образованию химических связей. Количественной мерой В. обычно принято считать число других атомов в молекуле, с которыми данный атом образует связи. В. одно из фундаментальных… … Большая советская энциклопедия
VSEPR theory — Valence shell electron pair repulsion (VSEPR) theory is a model in chemistry used to predict the shape of individual molecules based upon the extent of electron pair electrostatic repulsion.[1] It is also named Gillespie–Nyholm theory after its… … Wikipedia
Interhalogen — The halogens react with each other to form interhalogen compounds.The general formula of most interhalogen compounds is XYn, where n = 1, 3, 5 or 7 (X is the less electronegative of the two halogens). They are all prone to hydrolysis, and ionise… … Wikipedia
Inorganic compounds by element — This page aims to list concisely all of the common inorganic and organometallic compounds of each element, whether or not they have an existing page. These are compounds that may warrant their own individual pages. Compounds are listed… … Wikipedia
Berry-Mechanismus — Pseudorotation ist ein Phänomen, das in der Stereochemie auftritt und den schnellen Wechsel der Positionen von Atomen oder atomaren Baugruppen in Molekülen und Komplexverbindungen beschreibt. Durch die Pseudorotation entstehen kurzzeitig… … Deutsch Wikipedia



