- Heptafluorure d'iode
-
Heptafluorure d'iode 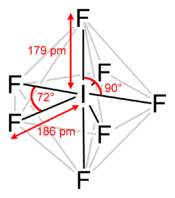
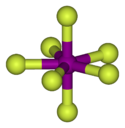
Structure de l'heptafluorure d'iodeGénéral No CAS No EINECS Propriétés chimiques Formule brute IF7 Masse molaire[1] 259,89329 ± 3,0E-5 g·mol-1
F 51,17 %, I 48,83 %,Propriétés physiques T° fusion 4,5 °C à 101,3 kPa
Jusqu'à 6 °C sous pressionT° ébullition 4,77 °C à 101,3 kPa Masse volumique 2 800 kg·m-3 à 6 °C Unités du SI & CNTP, sauf indication contraire. L'heptafluorure d'iode est le composé de formule IF7[2],[3]. Cette molécule a une géométrie bipyramidale pentagonale peu courante[4].
L'heptafluorure d'iode se présente sous forme d'un solide cristallin blanc qui fond à 4,5 °C mais bout dès 4,77 °C en formant une vapeur dense à l'odeur âcre de moisi. C'est un composé très irritant pour la peau et les muqueuses.
On le prépare en faisant barboter du fluor F2 dans du pentafluorure d'iode IF5 liquide à 90 °C puis en chauffant la vapeur à 270 °C. Une autre méthode, qui permet de limiter la formation d'IOF5 et des impuretés issues de l'hydrolyse, consiste à partir d'iodure de palladium PdI2 ou de potassium KI[5],[6].
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Macintyre, J. E. (Ed. 1992) Dictionary of Inorganic Compounds (Vol. 3), Chapman & Hall, Londres.
- O'Neil, Maryadele J. (Ed. 2001) The Merck Index (13th ed.), Merck, Whitehouse Station (New Jersey).
- K. O. Christe, E. C. Curtis, D. A. Dixon, « On the problem of heptacoordination: vibrational spectra, structure, and fluxionality of iodine heptafluoride », dans Industrial & Engineering Chemistry, vol. 115, no 4, 1993, p. 1520–1526 [lien DOI]
- W. C. Schumb, M. A. Lynch, Jr., « Iodine Heptafluoride », dans Industrial & Engineering Chemistry, vol. 42, no 7, 1950, p. 1383–1386 [lien DOI]
- Ruff O., Keim R., « "Das Jod-7-fluorid" (The iodine-7-fluoride) », dans Zeitschrift für Anorganische und Allgemeine Chemie, vol. 193, no 1/2, 1930, p. 176–186 [lien DOI]
Article connexe
Wikimedia Foundation. 2010.
