- Anti-corps
-
Anticorps
Un anticorps est une protéine complexe utilisée par le système immunitaire pour détecter et neutraliser les antigènes de manière spécifique. Les anticorps sont sécrétés par des cellules dérivées des lymphocytes B : les plasmocytes.
Les anticorps constituent l'immunoglobuline principale du sang, aussi on utilise parfois le terme immunoglobuline à la place du mot anticorps, mais cet emploi est abusif.
Dans le cas de maladies auto-immunes, on parle d'auto-anticorps
Sommaire
Structure générale
Les anticorps sont des glycoprotéines de la superfamille des immunoglobulines formées de 4 chaînes polypeptidiques (150.000 uma): 2 chaînes lourdes (H pour heavy de 50.000uma chacune, en violet sur la figure 1) et 2 chaînes légères (L pour light de 25.000 uma chacune, en vert) qui sont reliées entre elles par un nombre variable de ponts disulfures (en rouge) assurant une flexibilité de la molécule. Ces chaînes forment une structure en Y et sont constituées de domaines immunoglobulines de 110 acides aminés environ. Chaque chaîne légère est constituée d'un domaine constant et d'un domaine variable; les chaînes lourdes sont composées d'un fragment variable et de 3 ou 4 fragments constants selon l'isotype. Pour un anticorps donné, les deux chaînes lourdes sont identiques, de même pour les deux chaînes légères.
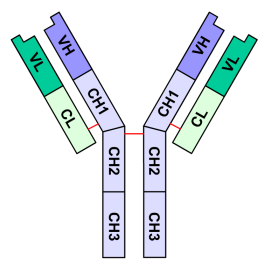
Figure 1 : Schéma d'un anticorps.Domaines constants
Les domaines constants sont caractérisés par une séquence en acides aminés très proche d'un anticorps à l'autre, caractéristiques de l'espèce et de l'isotype. Chaque chaîne légère en possède un exemplaire noté CL. Les chaînes lourdes comportent, selon l'isotype, trois ou quatre domaines constants CH1, CH2, CH3 et CH4.
Les domaines constants ne sont pas impliqués dans la reconnaissance de l'antigène, mais interviennent dans l'activation du système du complément. Les cellules immunitaires possédant les récepteurs aux fragments constants (RFc) sont capables de lier les anticorps.Domaines variables
Un anticorps possède quatre domaines variables situés aux extrémités des deux « bras ». L'association entre un domaine variable porté par une chaîne lourde (VH) et le domaine variable adjacent porté par une chaîne légère (VL) constitue le site de reconnaissance (ou paratope) de l'antigène. Ainsi, une molécule d'immunoglobuline possède deux sites de liaison à l'antigène, un au bout de chaque bras. Ces deux sites sont identiques (mais destiné à différents épitopes), d'où la possibilité de lier deux molécules d'antigène par anticorps.
Fragments
Le clivage enzymatique spécifique permet d'isoler différents fragments :
- le fragment Fc (cristallisable). Il est le support des propriétés biologiques de l'immunoglobuline, en particulier sa capacité à être reconnu par des effecteurs de l'immunité ou à activer le complément. Il est constitué des fragments constants des chaînes lourdes (CH2) au-delà de la région charnière (hinge). Il NE RECONNAIT PAS L'ANTIGENE
- le fragment Fv. C'est le plus petit fragment gardant les propriétés de l'anticorps qui possède des domaines immunoglobuline. Il est constitué uniquement des régions variables Modèle:VL et VH, il fixe donc l'antigène avec la même affinité que l'anticorps complet et est monovalent.
- le fragment Fab. Il a la même affinité pour l'antigène que l'anticorps complet. Le fragment Fab est formé de la chaîne légère en entier (Modèle:VL+CL) et d'une partie de la chaîne lourde (VH+CH1). Il est monovalent.
- le fragment F(ab')2. Il correspond à l'association de deux fragments Fab reliés par une petite partie des parties constantes des chaînes lourdes, la région charnière (hinge). Il a la même affinité que l'anticorps pour l'antigène et est divalent.
Isotypie, Allotypie, Idiotypie
Isotypie
Les anticorps (historiquement nommés Ig car ils ont servi à la définition du terme immunoglobuline) sont subdivisés en classes ou isotypes, selon la structure des domaines constants des chaînes lourdes : les chaînes γ, α, μ, ε et δ correspondent respectivement aux immunoglobulines IgG, IgA, IgM, IgE et IgD (voir Tableau 1). Il existe également des sous-classes d'immunoglobulines, reflétant des différences plus fines entre chaînes lourdes. L'homme possède ainsi quatre sous-classes d'IgG et 2 sous-classes d'IgA. Il existe également des isotypes de chaînes légères, celles-ci pouvant être κ (kappa) ou λ (lambda).
IgG IgA IgM IgE IgD Localisation sang muqueuses
sécrétionsLymphocyte B
sangbasophiles
mastocytesLymphocyte B Proportion 70% à 75% 15% à 20% des
anticorps sériques10% moins de 1% moins de 1% Valence1 2 2 à 4 2 à 10 2 2 Rôles neutralisation des toxines, bactéries et virus agglutination,
neutralisation des bactéries, virusagglutination,
voie classique du complémentallergies,
neutralisation de parasitesactivation du lymphocyte B Tableau 1 : Propriétés des différents isotypes d'immunoglobulines.
La valence de l'IgM de 10 n'est que théorique. En effet, bien que cet isotype d'anticorps soit de structure pentamérique, la gène stérique occasionnée lors de la liaison aux épitopes des antigènes fait que la valence réelle est plus proche de 5, voire 6.
Allotypie
C'est en 1956 que Grubb et Laurell ont découvert le système Gm, système de groupe des immunoglobulines IgG. Ce système met en évidence les divers allotypes des chaînes lourdes. Il permet également de différencier les molécules des quatre sous-classes, IgG1, IgG2, IgG3, IgG4.
C. Ropartz et coll. en 1961 ont découvert le système km (à l'origine appelé Inv), porté par la chaîne légère Kappa, cet allotype est donc présent sur toutes les classe d'immunoglobulines.
Enfin le système ISf situé sur la chaîne lourde γ1 des IgG1, l'expression de cette spécificité augmentant avec l'âge, de 25% des sujets avant 20 ans à 60% au-delà de 70 ans, chez les caucasiens.
Les allotypes définis par le système Am sont situés sur les IgA, et plus précisément sur les chaînes α2. Il existe deux isotypes α1 et α2 de chaînes α, caractérisant les sous-classes Am1 et Am2 des IgA.
Idiotypie
L'idiotype est un épitope propre à une molécule issue d'un seul clone. Cet épitope fait partie ou est très proche du site de reconnaissance de l'antigène, et est donc situé sur la partie variable, Fab (fragment antigen binding), de l'immunoglobuline. Autrement dit, le paratope ou sa région voisine d'une immunoglobuline peut être reconnu comme un épitope par certains lymphocytes. D'où la notion de réseau idiotypique.
Rôle des anticorps
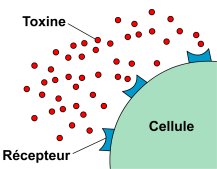
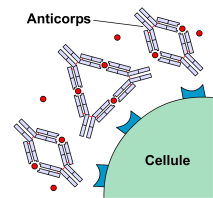
Figure 2 : Toxines bactériennes au
voisinage d'une cellule (haut),
neutralisation par des anticorps (bas).Au cours de la réponse immunitaire, les anticorps ont trois fonctions principales : se lier à l'antigène, activer le système du complément et recruter des cellules immunocompétentes.
Liaison à l'antigène
Les anticorps ont la capacité de reconnaître et de se fixer de manière spécifique sur un antigène. Cette spécificité est conférée par la présence de domaines extrêmement variables aux extrémités des anticorps. La reconnaissance entre antigène et anticorps est par exemple mise à profit dans la lutte contre les toxines bactériennes. Ces toxines agissent en se fixant sur des récepteurs présents à la surface des cellules de l'organisme, ce qui provoque des dérèglements importants de l'activité cellulaire. En se fixant sur ces toxines, les anticorps anti-toxine les neutralisent et préviennent les liaisons avec les récepteurs cellulaires (voir figure 2).
De la même manière, de nombreux virus et bactéries n'exercent leur pathogénicité qu'après fixation aux cellules de l'organisme. Les bactéries utilisent des adhésines qui sont des molécules d'adhésion aux membranes cellulaires et les virus possèdent des protéines de fixation sur leur enveloppe externe. Les anticorps anti-adhésines et anti-protéines de la capside virale bloquent l'action de ces agents pathogènes en se liant sur les molécules de fixation.
Activation du complément
Les anticorps protègent également l'organisme en déclenchant la cascade du complément. Il s'agit d'un ensemble de protéines du plasma dont l'activation (par la voie classique dans le cas d'anticorps) permet de détruire des bactéries par perforation et de faciliter la phagocytose, l'élimination des complexes immuns et la libération de molécules chimiotactiques. Ce qui amène à la lyse de l'élément pathogène. Ces protéines sériques sont des médiateur de l'inflammation.
Activation de cellules immunocompétentes
Après avoir reconnu un antigène grâce à sa partie variable, un anticorps peut se lier à des cellules du système immunitaire par sa partie constante. Ces interactions revêtent une grande importance dans le déroulement de la réponse immunitaire. Ainsi, les anticorps fixés sur une bactérie peuvent se lier aux macrophages et déclencher une phagocytose. Les lymphocytes NK (Natural Killer) peuvent exercer leur cytotoxicité et lyser des bactéries opsonisées par des anticorps.
Synthèse des anticorps
Généralités
Les anticorps sont codés par des gènes subissant une recombinaison V(D)J dans les lymphocytes B. Cette recombinaison est, en association avec les phénomènes d'hypermutation somatique et de variabilité jonctionnelle, la source de leur diversité.
Commutation de classe
Fichier:Commutation isotypique.jpg
Commutation isotypique.Lors de la maturation d'un lymphocyte B, et suivant les stimuli qui ont accompagné cette maturation, les clones de cellules B reconnaissant l'épitope subissent une commutation de classe. Les cellules B immatures, qui de base n'expriment que des IgM et des IgD, peuvent évoluer pour ne plus produire qu'un seul isotype (IgM, IgE, IgA ou IgG), en opérant une recombinaison du gène codant le fragment Fc des chaines lourdes, mais en gardant intact le fragment variable. Ce changement de fragment Fc est également et plus souvent appelé commutation isotypique.
Ce phénomène est possible par l'arrangement des gènes codant les domaines CH : sur le génome, les segments de gène codant un isotype sont successifs et précédés d'une séquence de commutation. A la réception d'un signal extracellulaire de commutation, le lymphocyte B synthétise une recombinase qui forme une boucle non fonctionnelle entre les séquences de commutation : cette boucle rapproche un segment codant un domaine constant et l'association VDJ déjà formée.
Exemple : La production d'interleukine 4 et 5 par le lymphocyte TH2 entraîne une commutation isotypique d'une IgM vers une IgE.
Anticorps monoclonaux et polyclonaux
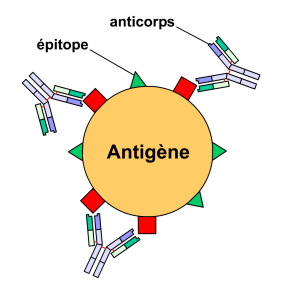
Figure 3 : Anticorps monoclonaux,
liaison à un épitope spécifique.
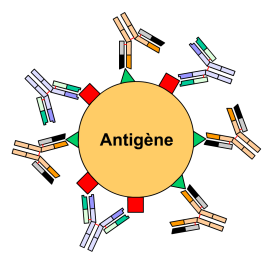
Figure 4 : Anticorps polyclonaux,
liaison à des épitopes différents.Un agent pathogène (bactérie, virus, etc.) est reconnu par le système immunitaire par l'intermédiaire d'antigènes. Un antigène possède généralement plusieurs épitopes différents qui sont autant de sites de liaison aux anticorps. On peut classer une population d'anticorps selon sa capacité à reconnaître un seul ou plusieurs épitopes. On parle alors respectivement d'anticorps monoclonaux et polyclonaux.
Anticorps monoclonaux
Les anticorps monoclonaux sont des anticorps ne reconnaissant qu'un seul type d'épitope sur un antigène donné (voir figure 3). Ils sont par définition tous identiques et produits par un seul clone de plasmocyte.
Les anticorps monoclonaux sont très largement utilisés en biologie et en médecine, à la fois comme outils de diagnostic et dans des buts thérapeutiques. Les anticorps monoclonaux utilisés comme médicaments ont tous une DCI se terminant par « mab », acronyme de « monoclonal antibody » comme par exemple le rituximab. Ils sont par exemple utilisés dans les tests de grossesse du commerce, ainsi que dans de nombreux domaines de la recherche en biologie et par de nombreuses techniques (cytométrie en flux, western blots...). Ils sont aussi de plus en plus utilisé dans les tests en laboratoire d'immuno-hématologie pour rehausser les réactions positives.
Produire des anticorps monoclonaux in vitro a longtemps été difficile, en raison de la faible durée de vie des cellules sécrétrices d'anticorps, les plasmocytes. Les anticorps étaient alors obtenus in vivo en injectant chez l'animal un antigène donné et en recueillant les anticorps dans son sang. Cette méthode coûteuse ne donnait qu'une faible quantité d'anticorps, pollués par de nombreuses impuretés.
A la fin des années 1970, César Milstein et Georges Köhler ont développé la technique des hybridomes ; L'antigène est injecté chez l'animal, et des cellules de rate en sont prélevées après quelques semaines. Dans ces cellules se trouvent des plasmocytes sécrétant des anticorps dirigés spécifiquement contre l'antigène choisi. Ces plasmocytes sont alors fusionnés in vitro avec des myélomes, qui sont des cellules tumorales ayant la propriété de se multiplier indéfiniment. Les cellules hybrides obtenues (dites « hybridomes » sont sélectionnées puis multipliées dans un milieu de culture approprié. Elles y produisent des anticorps monoclonaux, très purs et en quantités importantes.Le génie génétique permet aujourd'hui de produire des anticorps monoclonaux utilisables en pratique clinique humaine. Mais la plupart des anticorps étant produits dans des cellules de rongeurs (souris, rat, hamster, lapin plus rarement poulet, Mulet), ils déclenchent une réaction immunitaire lors de leur injection à un patient. Cette immunité inactive progressivement l'action bénéfique de l'anticorps. Pour éviter cela, on cherche à produire des anticorps chimériques « humanisés », modifiés par génie génétique pour remplacer au maximum les fragments constants Fc de l'espèce d'origine par des fragments humains.
En cas de pandémie (de grippe aviaire) par exemple, L’immunothérapie passive des malades, par des anticorps monoclonaux est une des solutions envisagées par les chercheurs qui en 2007 testaient déjà son efficacité sur l'animal[1], avec des résultats laissant penser que des anticorps monoclonaux d'origine humaine pourraient être produits à partir du sang de patients ayant guéri d'une grippe à H5N1 (ou de convalescents le cas échéants) et contribuer à enrayer une épidémie et à limiter le nombre de morts (en prophyllaxie unique, ou comme traitement complémentaire).
Anticorps polyclonaux
Les anticorps polyclonaux sont un mélange d'anticorps reconnaissant différents épitopes sur un antigène donné, chaque idiotype étant sécrété par un clone de plasmocyte différent. Au cours de la réponse immunitaire, un organisme synthétise des anticorps dirigés contre plusieurs épitopes d'un antigène : la réponse est dite polyclonale. In vivo, la réponse est toujours polyclonale, sauf cas exceptionnels (vaccination par exemple). Cet exemple est en fait un exemple d'anticorps polyclonal monospécifique qui est en fait un anticorps qui reconnaît différents épitopes du même antigène alors qu'un anticorps polyclonal reconnaît les épitopes de différents antigènes.
Voir aussi
Articles connexes
Bibliographie
- Jeremy Berg, John Tymoczko, Lubert Stryer, Biochemistry, W.H. Freeman and Company, New York, 2002. (ISBN 0-71674-684-0)
- Neil Campbell, Jane Reece, Biologie, De Boeck, 1995. (ISBN 2-80412-084-8)
- Charles Janeway, Paul Travers, Immunobiology, Garland Publishing, New York and London, 2001. (ISBN 0-81533-642-X)
Notes et références
- ↑ Simmons CP, Bernasconi NL, Suguitan Jr. AL, Mills K, Ward JM, et als. Prophylactic and therapeutic efficacy of human monoclonal antibodies against H5N1 influenza, PLoS Med 2007;4(5): e178 doi:10.1371
Catégories : Système immunitaire | Glycoprotéine | Anticorps
Wikimedia Foundation. 2010.
