- Anhydride d'acide
-
Un anhydride d'acide est un composé organique qui résulte de la déshydratation (perte d'une molécule H2O) d'un acide organique (acide carboxylique, acide sulfonique, acide phosphorique, etc.) ou inorganique (acide nitrique, acide sulfurique, etc.). La seule condition pour que l'anhydride d'un acide existe est que l'acide soit oxygéné.
Par exemple, les anhydrides d'acide carboxylique :
Leur formule générale est : R-CO-O-CO-R'. Leur nom est anhydride carboxylique ou anhydride alcanoïque.Sommaire
Formation
Les anhydrides d'acide carboxylique sont issus de la réunion de deux fonctions acides carboxyliques, suivant la réaction de déshydratation:
R-COOH + R'-COOH = R-CO-O-CO-R' + H2O
Cette réaction est réversible : les anhydrides formés peuvent subir une hydrolyse très facilement, y compris avec l'humidité de l'air, ce qui leur confère parfois un gout piquant.
On peut aussi former des anhydrides d'acide en utilisant un chlorure d'acyle et un carboxylate. R-COCl + R'-COO– = R-CO-O-CO-R' + Cl–
Nomenclature
On nomme le composé anhydride alcanoïque alcanoïque, les deux derniers mots correspondant aux noms de la chaine carbonée des 2 acides dont est issu l'anhydride, l'ordre étant l'ordre alphabétique. Si les deux substituants sont les mêmes, on ne met le nom qu'une fois.
Exemple : (CH3CO)2O : anhydride acétique (ou éthanoïque)
CH3-CO-O-CO-C2H5 : anhydride éthanoïque propanoïque.
Certains anhydrides ont des noms usuels qui diffèrent de cette nomenclature, comme par exemple l'anhydride maléique, formé à partir de l'acide maléique.
Réactivité
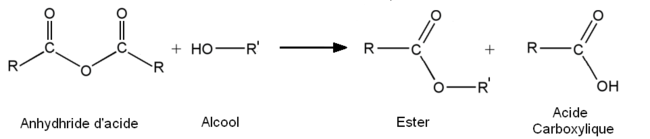
Les anhydrides d'acide sont des dérivés d'acides carboxyliques et réagissent de façon similaire. Les deux carbones portant les liaisons carbonyles (C=O) sont électrophiles et peuvent donc réagir avec des nucléophiles (ici noté Nu-) suivant la réaction :
R-CO-O-CO-R + Nu– = R-CO-Nu + R-CO-O–
Cela permet par exemple de former des esters avec un rendement proche de 100% :
Les dianhydrides
Les dianhydrides sont des molécules qui contiennent deux fonctions anhydride d'acide. Ils sont surtout utilisés pour synthétiser des polyimides et plus rarement des polyesters et des polyamides.
Exemples de dianhydrides :
- Dianhydrides avec une jonction linéaire liant les deux fonctions anhydrides : 3,3’, 4,4’ - dianhydride oxydiphtalique (ODPA), 3,3’, 4,4’-benzophénone dianhydride tétracarboxylique (BTDA), anhydride 4,4’-(hexafluoroisopropylidène) diphtalique (6FDA),
- Dianhydrides avec une jonction cyclique liant les deux fonctions anhydrides : anhydride pyromellitique (PMDA), dianhydride 1,4-benzoquinonetétracarboxylique, dianhydride éthylènetétracarboxylique.
Ayant une jonction linéaire, la première famille de dianhydride présente une plus grande flexibilité et une meilleure solubilité.
Les polyanhydrides
Les polyanhydrides sont une classe de polymères caractérisés par des liaisons anhydrides qui lient les motifs de répétition de la chaîne squelettique du polymère.
Wikimedia Foundation. 2010.