- Ion hydronium
-
Ion hydronium 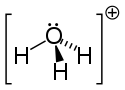
Structure de l'ion hydronium.Général Nom IUPAC oxonium No CAS PubChem ChEBI SMILES InChI Propriétés chimiques Formule brute H3O+(aq) Masse molaire[1] 19,0232 ± 0,0005 g·mol-1
H 15,9 %, O 84,1 %,pKa -1,7 à 25 °C Unités du SI & CNTP, sauf indication contraire. L'ion hydronium est l'ion oxonium de formule H3O+(aq). Il existe à l'état libre essentiellement en solution aqueuse, où il résulte de la protonation d'une molécule d'eau par solvatation d'un acide, mais peut aussi exister à l'état solide en formant un sel avec un acide fort. C'est également un ion moléculaire abondant dans le milieu interstellaire, où il résulte de l'interaction de molécules d'eau avec le rayonnement cosmique.
Sommaire
Nomenclature
La nomenclature de l'UICPA relative à la chimie organique recommande de désigner l'ion H3O+ par oxonium. Le terme hydroxonium peut également être employé afin de lever toute ambiguïté. Un projet de recommandation UICPA préconiserait également l'emploi du terme oxydanium dans le cadre de la chimie inorganique spécifiquement, mais cette dénomination est aujourd'hui en pratique inusitée.
Géométrie
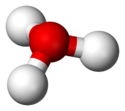
Dans la mesure où l'ion O+ et l'atome N ont le même nombre d'électrons, l'ion H3O+ est isoélectronique avec la molécule d'ammoniac NH3, d'où sa géométrie pyramidale trigonale avec, au sommet, l'atome d'oxygène. L'angle H-O-H est de l'ordre de 113°[2].
Solvatation
La solvatation de l'ion hydronium dans l'eau n'est pas encore pleinement caractérisée. La géométrie prépondérante déduite de la cryoscopie de l'eau serait H3O+(H2O)6 : chaque ion est en moyenne solvaté par six molécules d'eau, qui ne peuvent plus solvater d'autre ion.
D'autres structures de solvatation font intervenir davantage de molécules d'eau, notamment H3O+(H2O)20 dans laquelle l'ion hydronium est au centre d'un dodécaèdre d'eau. Des simulations réalisées par la méthode ab initio de la chimie quantique indiqueraient cependant que le proton hydraté se situerait en moyenne plutôt à la surface de l'agrégat H3O+(H2O)20.
Une équipe californienne a proposé en 2010[3] un nouveau modèle fondé sur ses analyses en spectroscopie infrarouge d'après lequel les protons sont solvatés sous forme d'agrégats [H13O6]+ dans lesquels la charge électrique positive serait répartie indistinctement à travers les six molécules d'eau.
Le monomère H3O+ en phase liquide a été identifié en 1979 par résonance magnétique nucléaire à l'oxygène 17[4] dans une solution superacide non aqueuse faiblement nucléophile de HF-SbF5SO2 (fluorure d'hydrogène, pentafluorure d'antimoine, dioxyde de soufre).
Autoprotolyse de l'eau
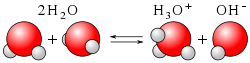
L'ion hydronium est présent en permanence dans l'eau, du fait de la réaction d'autoprotolyse :
- Tout d'abord il y a dissociation d'une molécule d'eau :
- H2O
 H+ + HO-
H+ + HO-
- Puis une seconde molécule d'eau solvate le proton libéré :
- H2O + H+
 H3O+
H3O+
- Enfin, le proton solvaté obtenu, appelé ion hydronium, est hydraté en solution et noté de ce fait H3O+(aq), abrégé de « aqueux » en référence au fait qu'il est en solution.
Le schéma réactionnel global peut s'écrire :
- 2 H2O
 H3O+(aq) + HO-(aq)
H3O+(aq) + HO-(aq)
HO-(aq) étant l'ion hydroxyde, lui aussi solvaté.
pH de l'eau pure à 25 °C
La constante d'équilibre de l'autoprotolyse de l'eau à 25 °C vaut :
- Keq = [H3O+] × [HO-] / [H2O]2 = 3,23×10−18.
La constante d'ionisation de l'eau à 25 °C, qui élimine la molarité de l'eau dans cette équation, s'écrit :
- Ke = Keq × [H2O]2 = [H3O+] × [HO-] = 10-14,
ce qui signifie que :
- [H3O+] = [HO-] = 10-7,
d'où la définition du pH de l'eau pure à 25 °C :
- pH = -log10([H3O+]) = 7.
L'ion hydronium est responsable de la propriété des acides selon la définition de Joannes Brønsted. Il est présent dans toute solution aqueuse en équilibre avec l'ion hydroxyde HO-. C'est la mesure de sa concentration qui permet de déterminer le pH de la solution.
Références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Jian Tang et Takeshi Oka, « Infrared Spectroscopy of H3O+: The ν1 Fundamental Band », dans Journal of Molecular Spectroscopy, vol. 196, no 1, juillet 1999, p. 120-130 [texte intégral (page consultée le 17 novembre 2010)]
DOI:10.1006/jmsp.1999.7844 - (en) Evgenii S. Stoyanov, Irina V. Stoyanova et Christopher A. Reed, « The Structure of the Hydrogen Ion (Haq+) in Water », dans Journal of the American Chemistry Society, vol. 132, no 5, 2010, p. 1484-1485 [texte intégral (page consultée le 18 novembre 2010)]
DOI:10.1021/ja9101826 - (en) Gheorghe D. Mateescu, George M. Benedikt, « Water and related systems. 1. The hydronium ion (H3O+). Preparation and characterization by high resolution oxygen-17 nuclear magnetic resonance », dans Journal of the American Chemical Society, vol. 101, no 14, 1979, p. 3959-3960 [texte intégral (page consultée le 18 novembre 2010)]
DOI:10.1021/ja00508a040
Wikimedia Foundation. 2010.