- Formule des insaturations
-
Composé insaturé
Les composés insaturés sont, en chimie organique, des composés dont le nombre total d'atomes est inférieur à celui que l'on peut déduire de la valence maximale de chacun des atomes constitutifs prise individuellement.
Sommaire
Saturation et insaturation
Insaturation de liaisons
Le terme d'insaturation peut donc indiquer l'existence de liaisons multiples (doubles et triples) au sein de la molécule étudiée, à l'inverse, un composé saturé est un composé présentant uniquement des liaisons simples. Ainsi, le cas le plus simple de composé insaturé à double liaison carbone-carbone est l'éthène (ou éthylène : H2C=CH2), dérivé de l'éthane (H3C-CH3), le cas le plus simple de composé à liaison triple carbone-carbone est l'acétylène (ou éthyne : HC≡CH). La liaison carbone-carbone dans l'éthane est une liaison sigma (simple) engageant deux électrons (un provenant de chaque carbone) alors que dans l'éthène, la liaison carbone-carbone est double (liaison sigma et liaison pi), engageant quatre électrons (deux en provenance de chaque carbone) et que dans l'éthyne, la liaison carbone est triple (liaison sigma et deux liaisons pi) engageant six électrons (trois en provenance de chaque carbone). Le terme d'insaturation indique en fait le fait que la liaison π peut être ouverte - par divers types de réactions chimiques, avec ou sans catalyseurs - et les électrons ainsi libérés engagés dans des liaisons covalentes avec d'autres atomes (typiquement de l'hydrogène).
Ainsi, une ouverture de la liaison π dans l'éthylène (ou des liaisons π pour l'acétylène) et une addition de dihydrogène H2 permet d'obtenir de l'éthane, le composé saturé correspondant.
D'un point de vue structural (distinct du point de vue énergétique) dans le cas de l'éthène, le carbone passant de trivalent (hybridation sp2, plane) à tétravalent (sp3, tridimensionnelle), « suscite » un degré de liberté supplémentaire permet de passer d'une configuration à une autre par rotation autour de la liaison carbone-carbone. Dans le cas de l'éthyne, la « rupture » des liaisons π permet de passer d'un composé monodimensionnel (linéaire en raison de l'hydridation sp) à un composé tridimensionnel, soit un gain de deux degrés de liberté.Les composés insaturés par liaisons sont en général moins stables au sens thermodynamique que les composés saturés correspondants : l'addition d'atomes sur les liaisons multiples est donc souvent favorisée en raison de cette instabilité, ce qui permet de les utiliser dans de nombreuses réactions comme produits initiaux. C'est d'ailleurs cette propriété qui est employé dans l'usage de l'éthyne (soudure à l'acétylène)
Cette instabilité se retrouve sous un autre aspect dans de nombreuses réactions chimiques, puisque certains des intermédiaires de réactions / états de transitions s'avèrent être des composés insaturés, comme par exemple dans la réaction de Wittig.Insaturation par formation d'un cycle
L'insaturation du composé peut être aussi due à la cyclicité de celui-ci. Le fait d'avoir une (ou plusieurs) chaîne(s) d'atomes fermées obéit à la définition donnée dans l'introduction en diminuant le nombre d'atomes constitutifs par rapport au nombre nécessaire pour arriver à saturation. De fait, chaque cycle présent enlève deux atomes à ce nombre, deux électrons (au moins) étant mis en commun par deux atomes pour le fermer.
L'exemple le plus simple à considérer est le cas du cyclohexane, cycloalcane de formule brute C6H12. L'alcane (linéaire) saturé correspondant est l'hexane de formule brute C6H14, s'écrivant en formule semi-developpée de la manière suivante : H3C-CH2-CH2-CH2-CH2-CH3. Le cyclohexane est de fait un isomère de l'hexène, alcène à 6 atomes de carbone, et les atomes de carbone correspondant aux groupes terminaux de l'hexane sont ici liés par une liaison covalente, ne permettant plus la liaison avec deux des six atomes d'hydrogène de ces groupes, ce qui est équivalent à l'insaturation provoquée par une double liaison, sans toutefois présenter de liaison pi caractéristique.
Les cycles peuvent être relativement complexes lorsque la molécule prend une troisième dimension, à l'instar de ceux du cubane (C8H8) qui en compte six, pour seulement huit atomes de carbone.Insaturations « composées »
Les composés saturés peuvent présenter plusieurs types d'insaturations de manière simultanée. Il en est par exemple ainsi avec les hydrocarbures aromatiques, qui présentent à la fois un caractère cyclique et des liaisons multiples (ou plutôt une délocalisation électronique des électrons pi). Un des meilleurs exemples est le benzène : composé aromatique à six carbones de formule C6H6, il présente l'équivalent de trois doubles liaisons en plus de sa cyclicité, portant son nombre d'insaturations à 4.
Nombre d'insaturations
Le nombre d'insaturations est, par définition, le compte des insaturations d'un composé chimique, pouvant être déterminé à partir de la formule brute du dit composé. Dans les cas les plus simples (c'est-à-dire si l'on excepte les composés à valence variable comme les éléments de transition), il est possible d'établir une formule simple pour calculer ce nombre.
Soit N le nombre d'insaturations. Un composé comme l'éthène comprend deux atomes tétravalents (C) et quatre monovalents (H), et présente une insaturation. Afin de déterminer l'existence d'insaturations, il convient de vérifier la possibilité ou non de former des liaisons π dans le composé étudié. Tout atome lié par une telle liaison apporte une demi-contribution à une insaturation. Tout atome monovalent ne peut créer de liaison pi, et donc indique une demi-saturation. La terminaison (extrémités de la molécule) apporte l'équivalent d'une insaturation pleine. Un atome non terminal tétravalent peut susciter deux demi-liaisons pi, un atome non terminal trivalent peut susciter une demi-liaison pi, un atome bivalent aucune.
Considérant ceci, la formule de détermination du nombre d'insaturations est la suivante :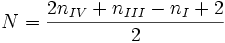 dans laquelle nX est le nombre d'atomes X-valent de la molécule étudiée.
dans laquelle nX est le nombre d'atomes X-valent de la molécule étudiée.Quelques exemples d'insaturations communes
Ici est listé quelques exemples de composés et fonctions communs possédant une ou plusieurs insaturations :
- fonction acide carboxylique -COOH : apporte une insaturation.
- fonction aldéhyde (-COH) ou cétone (-CO-) : apporte une insaturation.
- fonction cyanure : apporte deux insaturations.
- fonction ester (-COO-) : apporte une insaturation.
- fonction phényle (-C6H6) : apporte quatre insaturations.
- les fullerènes sont hautement insaturés : le C60 possède par exemple 61 insaturations.
Bibliographie
- (fr) Traité de Chimie Organique, Peter C. Vollhardt, Neil E. Schore, Paul Depovere (Trad.), De Boeck Université, 4e éd. 2004.
- (fr) Chimie Organique Avancée, tome 1, Carey & Sundberg, De Boeck Université, 3e éd. 1996.
- Portail de la chimie
Catégories : Chimie organique | Composé organique
Wikimedia Foundation. 2010.
