- Fluorure de platine(VI)
-
Hexafluorure de platine
hexafluorure de platine 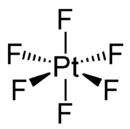
Général Synonymes hexafluorure de platine (VI) No CAS PubChem InChI Apparence solide volatile rouge foncé, gaz rouge Propriétés chimiques Formule brute PtF6 Masse molaire 309,074 g∙mol-1
F 36,88 %, Pt 63,12 %,Propriétés physiques T° fusion 61,3 °C[1] T° ébullition 69,1 °C[1] Précautions Directive 67/548/EEC Oxydant puissant Unités du SI & CNTP, sauf indication contraire. L'hexafluorure de platine est un composé chimique moléculaire de formule brute PtF6. C'est un solide rouge foncé, volatil qui forme un gaz rouge. Ces molécules contiennent du platine dans un état d'oxydation +6 et sont le seul exemple hexa-halogénure de la triade nickel, palladium, platine. Avec quatre électrons d, elles sont paramagnétiques avec un état fondamental triplet de spin (S=1).
PtF6 est un des plus puissants agents oxydants[2] -et aussi un puissant agent de fluoration- qui est bien connu pour sa réaction avec le xénon qui forme XePtF6, l'hexafluoroplatinate de xénon qui fut le premier composé d'un gaz rare synthétisé en 1962 par Neil Bartlett. Celui-ci avait auparavant observé que PtF6 est capable de réagir avec le dioxygène, O2 en l'oxydant pour former l'hexafluoroplatinate de dioxygène, (PtF6)-O2+.
Synthèse
PtF6 a été préparé pour la première fois en 1957 par réaction du fluor sur le platine métal[3]. Cette voie de synthèse reste une méthode de choix[4].
- Pt + 3 F2 → PtF6
PtF6 peut aussi être préparé par dismutation de PtF5. Ce dernier peut être obtenu par fluorination de PtCl2.
- PtCl2 + 2.5 F2 → PtF5 + Cl2
- 2 PtF5 → PtF6 + PtF4
Autres composés hexafluorures
Article principal : hexafluorure.Les hexafluorures neutres d'autres éléments sont aussi volatiles. Ce sont les composés d'osmium, iridium, rhodium, ruthénium, rhénium, tungstène, technetium et uranium. Tous sont des oxydant très agressifs. L'hexafluorure d'uranium et l'hexafluorure de tungstène sont utilisés dans les industries nucléaire et microélectronique, respectivement. Dans le groupe des non-métaux, le soufre, le xénon, le sélénium et le tellure forment des hexafluorures stables. L'hexafluorure de soufre est même si stable, ceci étant peut-être dû à des effets stériques, qu'il est utilisé comme liquide inerte dans des transformateurs électriques. Les analogues hexafluorure de sélénium et hexafluorure de tellure sont cependant extrêmement réactifs.
Comme les hexafluorures de Mo, Tc, Ru, Rh, W, Re, Os et Ir, PtF6 est octaédrique aussi bien à l'état solide qu'à l'état gazeux. Les liaisons Pt-F font 185 pm[4].
Notes
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Platinum hexafluoride ».
- ↑ a et b Perry, Dale L. and Sidney L. Phillips. Handbook of Inorganic Compounds. CRC Press, 1995. ISBN 0849386713. Google Book Search Result
- ↑ Grennwood, N. N.; Earnshaw, A.; Chemistry of the elements; Pregamon Press, Edition 1994, pp 1333-1340. (ISBN 0-08-022056-8)
- ↑ Platinum Hexafluoride, Weinstock, B.; Claassen, H. H.; Malm, J. G.; Journal of the American Chemical Society, 1957, volume 79, pp 5832 - 5832. DOI:10.1021/ja01578a073
- ↑ a et b Solid State Molecular Structures of Transition Metal Hexafluorides, Drews, T.; Supel, J.; Hagenbach, A.; Seppelt, K.; Inorganic Chemistry, 2006, volume 45, pp 3782-3788.DOI:10.1021/ic052029f
- Portail de la chimie
Catégories : Composé du fluor | Composé du platine | Fluorure | Gaz inorganique
Wikimedia Foundation. 2010.
