- 110-02-1
-
Thiophène
Thiophène 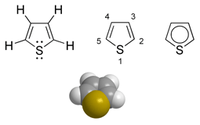
Structure chimique du thiophène Général Nom IUPAC Thiophène Synonymes Sulfure de divinylène
Thiacyclopentadiène
ThiofuraneNo CAS No EINECS Apparence liquide incolore, d'odeur âcre.[1] Propriétés chimiques Formule brute C4H4S [Isomères] Masse molaire 84,14 g∙mol-1
C 57,1 %, H 4,79 %, S 38,11 %,pKa 38,4 Propriétés physiques T° fusion -38 °C[1] T° ébullition 84 °C[1] Solubilité dans l'eau : nulle[1] Masse volumique (eau = 1) : 1.06[1],
2,9 (air=1)T° d’auto-inflammation 395 °C[1] Point d’éclair -1 °C[1] Limites d’explosivité dans l’air en volume % dans l'air : 1.5-12.5[1] Pression de vapeur saturante à 12,5 °C : 5.3 kPa[1] Thermochimie S0liquide, 1 bar 181 J/mol·K ΔfH0gaz 115,0 kJ/mol ΔfH0liquide 81 kJ/mol Cp 122.4 J/mol·K (liq.) Propriétés optiques Indice de réfraction 1,529 (20 °C) Précautions Transport - 2414 NFPA 704 Écotoxicologie LogP 1.81[1] Unités du SI & CNTP, sauf indication contraire. Le thiophène est un composé organique hétérocyclique aromatique. C'est un liquide limpide incolore ayant une odeur qui rappelle celle du benzène. Le thiophène est souvent trouvé naturellement dans le pétrole à des concentrations de quelques pourcents.
Le thiophène est un des composés utilisés pour dénaturer l'alcool.
La réaction de polymérisation du thiophène conduit au polythiophène.
Sommaire
Chimie
La chimie du thiophène est essentiellement marquée par son caractère aromatique (4 électrons apportés par les doubles liaisons, deux par le soufre). Le cycle peut donc subir les substititutions électrophiles aromatiques classiquement rencontrées sur les aromatiques, telles les halogénations, les réactions de type Friedel et Crafts (rarement en présence de chlorure d'aluminium, qui a tendance à favoriser des polymérisations par ouverture du cycle, néanmoins), des formylation de Wilsmeier-Haack, ...
De part la présence du soufre, les substitutions sont fortement orientées sur les carbones 2 et 5, et il est quasiment impossible d'orienter une réaction en position 3 ou 4 si ces deux positions ne sont pas déjà occupées. Une exception notable est par exemple l'isomérisation du 2-bromothiophène en 3-bromothiophène en présence de silice acide.
Le thiophène est cependant nettement plus fragile qu'un aromatique simple, et peut subir des réactions de dégradation en présence d'acide fort (notamment l'acide sulfurique) ou d'acide de Lewis (AlCl3).
L'hydrogénation des doubles liaisons est nettement plus simple que sur le benzène, mais il est très difficile de s'arrêter à une seule réaction.
Voir aussi
Composés structurellement ou chimiquement apparentés :
- Analogues du thiophène
Liens externes
Notes et références
- Portail de la chimie
Catégories : Noyau aromatique simple | Thiophène
Wikimedia Foundation. 2010.

