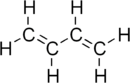- 106-99-0
-
Buta-1,3-diène
Buta-1,3-diène 
formule développée et modèle 3D du butadièneGénéral Nom IUPAC Buta-1,3-diène Synonymes Divinyle
Erythrène
Vinyl éthylèneNo CAS No EINECS Apparence gaz comprimé liquefié incolore, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C4H6 [Isomères] Masse molaire 54,0904 g∙mol-1
C 88,82 %, H 11,18 %,Propriétés physiques T° fusion -109 °C[1] T° ébullition -4 °C[1] Solubilité dans l'eau : nulle ([1] Masse volumique (eau = 1) : 0.6[1] T° d’auto-inflammation 414 °C[1] Point d’éclair -76 °C[1] Limites d’explosivité dans l’air en volume % dans l'air : 1.1-16.3[1] Pression de vapeur saturante à 20 °C : 245 kPa[1] Précautions Directive 67/548/EEC[4] 
T
F+Phrases R : 12, 45, 46, Phrases S : 45, 53, Transport 239 1010 [2]NFPA 704 SIMDUT[5] 



SGH[6] 


DangerClassification du CIRC Groupe 1 : Cancérogène pour l'homme[3] Écotoxicologie LogP 1.99[1] Unités du SI & CNTP, sauf indication contraire. Le buta-1,3-diène est un hydrocarbure de formule C4H6 gazeux incolore et inflammable. C'est l'isomère le plus courant du butadiène, raison pour laquelle il est souvent simplement appelé butadiène. C'est un important réactif qui utilisé dans la synthèse de nombreux polymères.
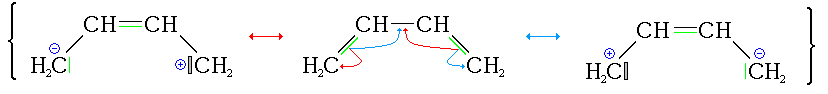
C'est le diène conjugué le plus simple. Il se liquéfie par refroidissement jusqu'à -4,4 °C ou par compression à 2,8 atm à 25 °C. Il est soluble dans les solvants organiques polaires tels le chloroforme et le benzène. Les réactions d'addition et de cyclisation sont les plus importantes.
Formules mésomères du buta-1,3-diène
Utilisation
Il est principalement utilisé dans la fabrication de caoutchouc synthétique, de vernis, du nylon et des peintures au latex (botanique). En raison de sa grande réactivité, le butadiène est utilisé en synthèse, en particulier dans les réactions de polymérisation. Un grand nombre de pneus de voiture sont fabriqués avec du caoutchouc buna, copolymère du butadiène et du styrène.
Le butadiène est le principal réactif pour la synthèse du chloroprène par chloration suivie d'un isomérisation et d'une déshydrochlorination. Ce diène est également utilisé pour produire l'adiponitrile et l'hexaméthylènediamine par réaction avec l'acide cyanhydrique. Plusieurs procédés utilisent le butadiène pour produire le butan-1,4-diol. Le butadiène est un excellent réactif pour le réaction de Diels-Alder et permet la synthèse du 4-vinylcyclohexène (réactif pour la production du styrène), du 1,5-cyclooctadiène et 1,5,9-cyclodecatriène.
Production et synthèse
Il n'existe pas à l'état naturel car sa réactivité est trop grande, mais est présent lors du craquage des hydrocarbures (5% de butadiène est produit dans le craquage des essences légères). Il est ensuite séparé du mélange par distillation dans les fractions C4. L'obtention du butadiène pur n'est pas possible par simple distillation de cette fraction, car le butane et le butadiène forme un azéotrope. Une séparation par extraction liquide-liquide ou par distillation extractive est nécessaire.
Le butadiène commercial est également synthétisé par déshydrogénation du butane, ou de mélanges de butène et de butane. La voie de synthèse la plus connue est le procédé de Houdry Catadiène en une étape[7]. A partir de n-butane ou de mélanges de n-butènes, une déshydrogénation catalysée par un mélange d'alumine et d'oxyde de chrome permet d'obtenir un flux de produits contenant 15-18% de butadiène à une température de 600-700°C et une pression de 10-70 kPa. Ce procédé a un rendement de 50%. La déshydrogénation n'est toutefois pas la voie de synthèse la plus utilisée et sert principalement quand la différence de prix entre les réactifs et le butadiène est élevée.
A l'origine, le diène était produit à partir de l'acétylène[7]. Deux procédés ont utilisé ce réactif, notamment le procédé Reppe encore utilisé de nos jours pour produire le tétrahydrofurane et le butan-1,4-diol
Le butadiène peut également être synthétisé à partir de l'éthanol en utilisant un catalyseur d'alumine et d'oxyde de magnésium ou d'oxyde de silicium.
Références
- ↑ a , b , c , d , e , f , g , h , i et j 1, 3 - BUTADIENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Entrée du numéro CAS « 106-99-0 » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 18 novembre 2008 (JavaScript nécessaire)
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 1 : Cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « buta-1,3-diène » sur ESIS, consulté le 15 février 2009
- ↑ « Butadiène-1,3 » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ a et b Joachim Grub and Eckhard Löser, Ullmann's Encyclopedia of Industrial Chemistry, Butadiene, Wiley-VCH Verlag GmbH & Co, 2002
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique extrêmement inflammable | Cancérogène chimique | Produit chimique mutagène | Diène | Monomère
Wikimedia Foundation. 2010.