- Acétonitrile
-
Acétonitrile 

Général Synonymes Cyanure de méthyle
Cyanométhane
EthanenitrileNo CAS No EINECS Apparence liquide incolore, d'odeur caractéristique[1] Propriétés chimiques Formule brute C2H3N [Isomères] Masse molaire[4] 41,0519 ± 0,002 g·mol-1
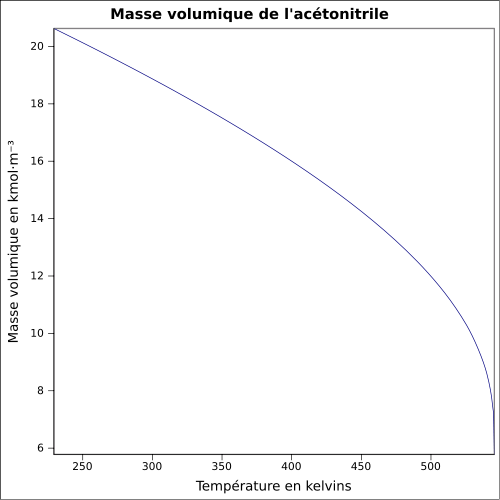
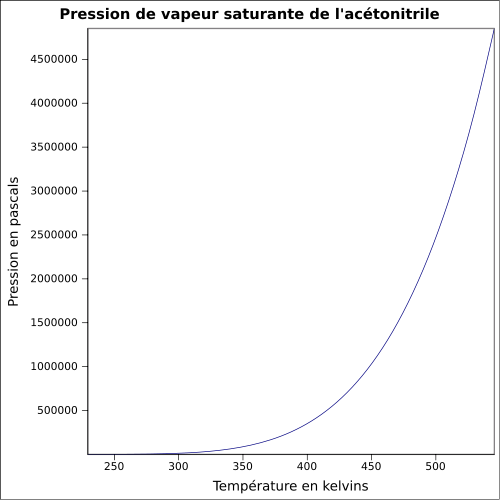
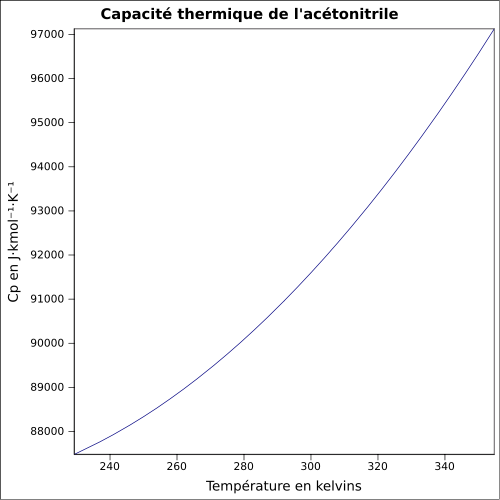
C 58,51 %, H 7,37 %, N 34,12 %,Moment dipolaire 3,92519 D [2] Diamètre moléculaire 0,436 nm [3] Propriétés physiques T° fusion -46 °C[1] T° ébullition 82 °C[1] Solubilité dans l'eau : miscible[1] Masse volumique 0,8 g·cm-3[1] T° d'auto-inflammation 524 °C[1] Point d’éclair 12,8 °C (coupelle fermée)[1] Limites d’explosivité dans l’air 3,0–16 %vol[1] Pression de vapeur saturante à 20 °C : 9,7 kPa[1] Viscosité dynamique 0.345 cP à 25 °C Point critique 48,3 bar, 274,75 °C [6] Thermochimie Cp Propriétés électroniques 1re énergie d'ionisation 12,20 ± 0,01 eV (gaz)[8] Propriétés optiques Indice de réfraction  1,341 [3]
1,341 [3]Précautions Directive 67/548/EEC 
Xn
FPhrases R : 11, 20/21/22, 36, Phrases S : (1/2), 16, 36/37, Transport - 1648 NFPA 704 SIMDUT[9] 

SGH[10] 

DangerÉcotoxicologie LogP -0,3[1] Seuil de l’odorat bas : 40 ppm
haut : 1 161 ppm[11]Unités du SI & CNTP, sauf indication contraire. L'acétonitrile (cyanure de méthyle) est un composé chimique de formule CH3CN. Ce liquide incolore, d'odeur sucrée, est le nitrile organique le plus simple, et très souvent utilisé en tant que solvant.
Sommaire
Production et applications industrielles
L'acétonitrile est obtenu comme sous-produit de la production de l'acrylonitrile, c'est pourquoi la tendance à la production d'acétonitrile suit généralement celle de l'acrylonitrile. Les plus grands producteurs de cette molécule aux USA sont INEOS, DuPont, J.T. Baker Chemical, et Sterling Chemicals. En 1992, 14 700 tonnes d'acetonitrile ont été produits aux États-Unis. En 2008, la crise économique ayant entrainé une baisse soudaine de la demande en fibres et résines acryliques, la production d'acrylonitrile et d'acétonitrile a chuté et le prix de l'acétonitrile a été multiplié par 15 en quelques mois[12]. L'acétonitrile est utilisé comme solvant, notamment dans l'industrie pharmaceutique, mais également comme intermédiaire réactionnel dans la production de bon nombre de substances chimiques des pesticides aux parfums.
Usages en laboratoire
C'est un solvant de choix pour tester une réaction chimique inconnue. Il est polaire, et son domaine liquide est assez étendu ce qui le rend commode. Il dissout une large gamme de composés sans encombre, conséquemment à la présence de protons non acides. L'acétone présente les mêmes propriétés mais il est plus acide et plus réactif envers les bases, et les nucléophiles. (Note : le pKa mentionné fait référence à celui de l'acide conjugué de l'acétonitrile, pas celui de la molécule elle-même). En chimie inorganique, l'acétonitrile est très employé comme ligand, abrégé MeCN. On l'utilise par exemple sous la forme PdCl2(MeCN)2 préparé en chauffant à reflux du dichlorure de palladium dans l'acétonitrile. C'est un solvant commun en Voltampérométrie cyclique en raison de sa constante diélectrique relativement élevée. L'acétonitrile est aussi souvent utilisée dans les colonnes de chromatographie, et en chromatographie liquide à haute performance (HPLC), où il sert de phase mobile pour la séparation de molécules.
Précautions
Il est nocif et inflammable. Il peut pénétrer par voie orale, cutanée ou par inhalation. Il est métabolisé en acide cyanhydrique et thiocyanate ce qui en fait un composé très dangereux pour la santé.
Liens externes
- WebBook page for C2H3N
- International Chemical Safety Card 0088
- National Pollutant Inventory - Acetonitrile fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- Fiche MSDS (acros)
Notes et références
- ACETONITRILE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Acétonitrile » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Acetonitrile sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- Chemistry World Vol. 6 No. 1, Janvier 2009, p. 18.
Wikimedia Foundation. 2010.