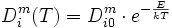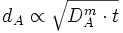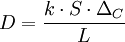- Diffusion moléculaire
-
Diffusion de la matière
 Pour les articles homonymes, voir diffusion.
Pour les articles homonymes, voir diffusion.La diffusion désigne la tendance naturelle d'un système à rendre homogènes les concentrations des espèces chimiques en son sein. C'est un phénomène de transport irréversible qui se traduit par la migration d'espèces chimiques dans un milieu. Sous l'effet de l'agitation thermique on observe un déplacement des constituants des zones de forte concentration vers celles de faible concentration. D'un point de vue phénoménologique, et au premier ordre, ce phénomène est régi par une loi de Fick.
Sommaire
Diffusion et migration
Le déplacement des atomes, ions ou molécules dans un milieu, que celui-ci soit solide (cristallin ou amorphe), liquide ou gazeux, est appelé de manière générale « migration ». La diffusion est la migration sous l'effet de l'agitation thermique, à l'exception des autres phénomènes. Elle intervient par exemple dans des procédés d'amélioration des caractéristiques mécaniques (traitements de surface comme la nitruration ou cémentation), la résistance à la corrosion et les procédés d'assemblage par brasage.
Lorsqu'un atome se déplace parmi des atomes de même nature, on parle d'autodiffusion. Par exemple, on parlera d'autodiffusion du fer pour désigner la migration d'un atome de fer dans un cristal de fer.
Lorsque l'on a deux milieux homogènes différents que l'on met en contact, on parle d'interdiffusion.
Historique
En 1827, le botaniste Robert Brown observe le mouvement erratique de petites particules de pollen immergées dans de l'eau. Il ne s'agit pas d'un phénomène de diffusion, puisque ce qui bouge est une particule macroscopique, mais cette « marche aléatoire » (random walk), autrement appelé par le nom de son observateur « mouvement brownien », servira de modèle pour la diffusion.
En 1896, Roberts-Austen, responsable de la monnaie en Grande-Bretagne, accole une plaquette d'or à une plaquette de plomb, fait chauffer le tout et mesure la profondeur de pénétration d'un métal dans l'autre. C'est la première mesure d'un coefficient d'interdiffusion à l'état solide.
En 1855, Adolph Fick propose des lois phénoménologiques, empiriques, inspirées des la lois de Fourier pour la chaleur (établies en 1822). C'est Albert Einstein qui démontrera les lois de Fick en 1905 avec ses travaux sur la loi stochastique. En 1908, Jean Perrin, fondateur du CNRS et prix Nobel de physique, fut le premier à mesurer la trajectoire de particules soumises au mouvement brownien et confirma ainsi l'analyse théorique d'Einstein.
Lois de Fick
Première loi de Fick
La première loi de Fick énonce que
- le flux de diffusion est proportionnel au gradient de concentration.
Cette loi est inspirée de la loi de Fourier sur la conduction de la chaleur. Elle peut être vue comme une définition du « vecteur densité de courant »
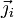 qui vérifie la seconde loi de Fick, en ce sens qu'elle ne contient pas la physique du phénomène de diffusion.
qui vérifie la seconde loi de Fick, en ce sens qu'elle ne contient pas la physique du phénomène de diffusion.Mathématiquement, cette loi s'exprime de la manière suivante :
- soit un milieu B dans lequel se trouve une espèce chimique A, soit une surface S ;
- si CA (x, y, z, t) est la concentration de A en un point donné ;
- on appelle
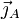 (molécule s-1m-2) le « vecteur densité de courant de particules » des particules de A ;
(molécule s-1m-2) le « vecteur densité de courant de particules » des particules de A ; - la première loi de Fick s'écrit :
également notée, avec l'opérateur nabla :
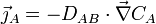 .
.
La grandeur DAB (m2s-1) est le coefficient de diffusion de A dans le milieu B considéré ; il dépend de la température, du milieu et de A.
À une dimension (par exemple en se plaçant sur l'axe des z), cette équation devient :
Ce vecteur donne accès au flux de particules de A à travers une surface S quelconque, c’est-à-dire le nombre de particules de A traversant cette surface par unité de temps : si on note
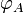 ce flux, on a
ce flux, on a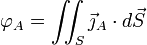 .
.
Seconde loi de Fick
La loi de la conservation des espèces indique que la variation par unité de temps de la quantité de particules i
dans un volume donné V est égale au flux sortant
du vecteur densité de courant de particules
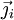 à travers la surface fermée S délimitant le volume V. On obtient la deuxième loi de Fick en identifiant les intégrands ci-dessous :
à travers la surface fermée S délimitant le volume V. On obtient la deuxième loi de Fick en identifiant les intégrands ci-dessous :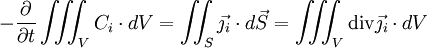 .
.
La deuxième égalité ci-dessus est due au théorème de la divergence, dit de « Green-Ostrogradsky », et le signe moins provient du fait que la concentration diminue quand le flux sortant augmente. On a donc
où div est l'opérateur divergence ; on le note aussi comme un produit scalaire formel avec l'opérateur nabla
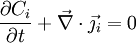 .
.
À une dimension, l'équation devient :
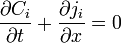 ou encore
ou encore 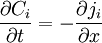 .
.
Similarité à l'équation de la chaleur
Si le coefficient de diffusion D est indépendant de la concentration, alors la réunion des 2 précédentes équation et de la règle d'analyse différentielle
donne l'équivalent de l'équation de la chaleur :
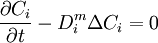 .
.
À une dimension, l'équation devient :
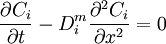 ou encore
ou encore 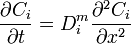 .
.
Activation thermique
L'origine de l'auto-diffusion est l'agitation thermique. La diffusion est donc thermiquement activée, et le coefficient de diffusion suit une loi d'Arrhénius :
où E est l'énergie d'activation, k est la constante de Boltzmann et T est la température absolue.
Mouvement brownien
Article détaillé : Mouvement brownien.Le déplacement de l'espèce chimique concernée peut se modéliser par le mouvement brownien comme l'a formalisé Einstein. Ceci permet de retrouver la première loi empirique de diffusion de Fick.
Mécanismes de diffusion
Diffusion dans les cristaux
Un solide cristallin est un arrangement régulier d'atomes, mais il présente des défauts. Ce sont ces défauts qui permettent la diffusion, et essentiellement les défauts ponctuels.
On distingue essentiellement deux mécanismes :
- le mécanisme lacunaire : le cristal présente des lacunes, c'est-à-dire que certains sites sont vides ; un atome voisin de la lacune peut donc sauter cette place vide et se déplacer d'une position ;
- le mécanisme interstitiel : si l'on représente les atomes comme des sphères dures, un cristal est un empilement de sphères dures et il reste de l'espace vide entre les sphères (voir l' article Empilement compact) ; un petit atome peut donc se glisser dans un de ces interstices, et sauter d'un interstice vers un interstice voisin.
Dans tous les cas, il s'agit de sauts atomiques d'une position vers une position voisine, sous l'effet de l'agitation thermique.
Mais un cristal dispose également d'autres défauts : dislocations, joints de grain et surfaces libres. La diffusion dans ces zones est plus rapide que dans la masse du cristal.
Mesure des coefficients de diffusion
Applications
Considérons un solide ne contenant pas d'espèce A. À un moment donné, on met une extrémité plane du solide en contact avec un milieu contenant une concentration constante de A. A passe alors en solution dans le solide et diffuse vers l'intérieur. On a donc à chaque instant t un profil de concentration c(x,t), x étant la profondeur par rapport au plan de contact. On peut définir le front de diffusion comme étant la profondeur dA où l'on a une concentration fixée, par exemple 1/10 de la concentration de saturation Cs.
La nature brownienne du mouvement permet de conclure que le front de diffusion avance selon une loi proportionnelle à la racine carrée du temps :
Cette situation correspond par exemple au sucre dont on trempe une extrémité dans le café, ou bien à un traitement de surface d'un métal avec une phase gazeuse ou liquide (nitruration, carburation...).
En biologie
Les symboles de cette formule sont respectivement :
- D le taux de diffusion en g⋅s-1 ou mol⋅s-1 ;
- k le coefficent de diffusion (de l'espèce chimique dans le milieu donné) en m2⋅s-1 ;
- S la surface d’échanges en m2 ;
- ΔC la différence de concentration de chaque coté de la membrane en g⋅m-3 ou mol⋅m-3 ;
- L l’épaisseur de la membrane en m.
Voir aussi
Bibliographie
- J. Philibert et coll., Métallurgie, du minerai au matériau, Dunod, 2002 (ISBN 2-10-006313-8), p. 398-437
Articles connexes
- Osmose
- Migration (matière)
- Équation de la chaleur
- Mouvement brownien
- Conduction thermique
- Équation de Mason-Weaver
Liens externes
- Portail de la chimie
- Portail de la physique
Catégories : Thermodynamique | Loi en physique
Wikimedia Foundation. 2010.

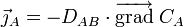
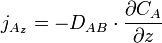
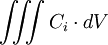
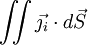
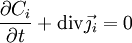
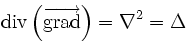 (
(