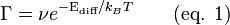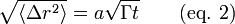- Diffusion superficielle
-
Diffusion de surface
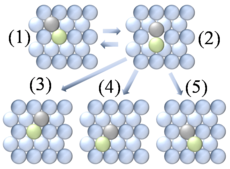
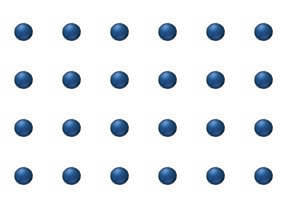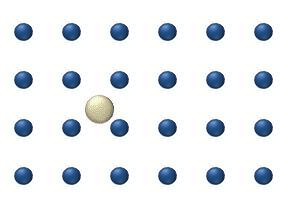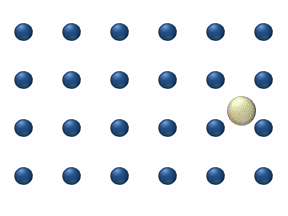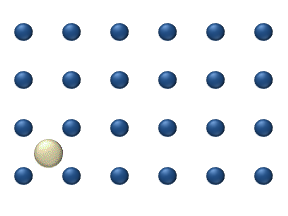 Figure 1. Modèle de diffusion d'un adatome sur un réseau de surface carré. La fréquence de vibration de l'adatome est plus grande que la fréquence des sauts aux sites voisins. Ainsi, le modèle montre deux types de sauts : les sauts aux sites voisins les plus proches, et aux prochains voisins les plus proches (en diagonale).[1]
Figure 1. Modèle de diffusion d'un adatome sur un réseau de surface carré. La fréquence de vibration de l'adatome est plus grande que la fréquence des sauts aux sites voisins. Ainsi, le modèle montre deux types de sauts : les sauts aux sites voisins les plus proches, et aux prochains voisins les plus proches (en diagonale).[1]
En science des matériaux, la diffusion de surface ou diffusion superficielle est un phénomène impliquant le déplacement d'adatomes, de molécules, et d'agrégats atomiques sur la surface de matériaux solides.[2] Les mécanismes par lesquels cette diffusion s'effectue ont une certaine importance, car ils conditionnent le développement de matériaux ayant des propriétés intéressantes.[3]
Le processus peut être considéré comme des particules sautant d'un site d'adsorption d'une surface à une autre, comme schématisé sur la figure 1. Comme pour la plupart des diffusions de la matière, ce mouvement est caractéristique d'un processus thermique dont la fréquence augmente avec la température. Il a été mis en évidence que de nombreux systèmes présentent un comportement de diffusion, qui dérive d'un modèle conventionnel de sauts aux voisins proches.[4] La diffusion à effet tunnel est un exemple particulièrement intéressant de mécanisme non conventionnel, dans lequel il a été montré que de l'hydrogène peut diffuser sur une surface métallique via l'effet tunnel.
Plusieurs techniques d'analyse peuvent être utilisées pour étudier les mécanismes de diffusion superficielle, les plus importantes sont la microscopie ionique, [5] la microscopie à effet tunnel.[6] Ce phénomène peut se rencontrer sur de nombreux matériaux, la plupart des expériences sont faites sur des surfaces cristallines. Dû aux contraintes expérimentales, les majorités des études de diffusion de surface sont limitées par la température de fusion du substrat, et les simulations à hautes températures montrent des résultats de processus d'échange multiple, mais qui n'ont pas pu être vérifiés à ce jour.[7]
Les mécanismes et les coefficients de diffusion superficielle sont affectés par plusieurs facteurs, comme la force de la liaison chimique surface-adparticule, l'orientation du cristal sur le réseau de surface, les forces attractives et répulsives existantes, et les gradients de potentiel chimique. Les transitions de phases, la croissance par épitaxie, la catalyse hétérogène sont des notions importantes de la science des surfaces.[8] Les phénomènes de diffusion des surfaces sont primordiaux pour l'industrie chimique et des semi-conducteurs. De nombreuses applications sont fondées sur la compréhension de ces phénomènes, on peut notamment citer les pots catalytiques, les circuits intégrés, ou encore l'halogénure d'argent dans les pellicules photographiques.[8]
Sommaire
Aspects cinétiques
Les aspects cinétiques de la diffusion superficielle peuvent être considérés par des adatomes résidant dans les sites d'adsorption, sur un réseau à deux dimensions, et et se déplaçant vers les sites adjacents (les plus proches voisins) par des processus de saut.[2],[9] La fréquence de saut est caractérisée par une fréquence d'essai et un facteur thermodynamique, lequel détermine la probabilité qu'un essai se concrétise en processus de saut. La fréquence d'essai ν est prise égale à la celle de vibration moléculaire de l'adatome, tandis que le facteur thermodynamique est le facteur de Boltzmann dépendant de la température et de l'énergie potentielle de la barrière de diffusion Ediff.
Le fréquence de saut est alors donnée par :
où
- ν est la fréquence d'essai ;
- Ediff l'énergie potentielle de la barrière ;
- Γ la fréquence de saut ;
- T la température ;
- et kB la constante de Boltzmann.
Ediff doit être plus petit que l'énergie de désorption afin que la diffusion se produise au lieu du processus de désorption. L'équation 1 montre clairement l'influence de la température sur la fréquence de saut. La manière selon laquelle la diffusion a lieu dépend de la relation entre Ediff et kBT. Lorsque Ediff est plus petit que kBT, le facteur thermodynamique est proche de l'unité, et Ediff n'est alors plus une barrière significative à franchir. Ce case est nommé diffusion mobile, est peu commun et a été observé dans seulement quelques systèmes.[10]
Dans la suite de l'article, on considère Ediff ≫ kBT, et donc
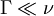 . Dans le cas d'une diffusion de Fick, il est possible d'extraire à la fois ν et Ediff d'un diagramme de Arrhenius, c'est-à-dire un diagramme représentant le logarithme du coefficient de diffusion D en fonction de 1/T.
. Dans le cas d'une diffusion de Fick, il est possible d'extraire à la fois ν et Ediff d'un diagramme de Arrhenius, c'est-à-dire un diagramme représentant le logarithme du coefficient de diffusion D en fonction de 1/T.Pour les cas, où il y a plus d'un mécanisme de diffusion qui intervient, il peut y avoir plusieurs Ediff et la distribution entre les différents processus peut changer avec la température.
Les statistiques de marche au hasard décrivent le déplacement quadratique moyen lors de la diffusion en termes de nombre de saut N et de distance a. Le nombre de sauts réussis est simplement Γ multiplié par le temps autorisé par diffusion, t. Dans la plupart des modèles de base, seulement les sauts adjacents sont considérés et a correspond à la distance entre deux sites d'adsorption. Le déplacement quadratique moyen est défini par :
Le coefficient de diffusion est donné par :
où z = 2 pour une diffusion à une dimension, comme par exemple pour une diffusion in-channel ; z = 4 pour un réseau carré ; z = 4 pour un réseau hexagonal.[11]
Régime
 Figure 3. Modèle de six adatomes diffusant sur un réseau carré de surface. Chaque adatome empêche les autres de se déplacer aux sites adjacents. Comme pour la loi de Fick, le flux est dans la direction opposé du gradient de concentration.[1]
Figure 3. Modèle de six adatomes diffusant sur un réseau carré de surface. Chaque adatome empêche les autres de se déplacer aux sites adjacents. Comme pour la loi de Fick, le flux est dans la direction opposé du gradient de concentration.[1]
Les adatomes peuvent diffuser de quatre manières différentes.[12] La diffusion de traceur et la diffusion chimique se différencient dans le niveau de couverture de l'adsorbat par rapport à la surface, tandis que la diffusion intrinsèque et la diffusion de transfert de masse différent par la nature de l'environnement de la diffusion.
La diffusion de traceur et la diffusion intrinsèque référent toutes deux aux systèmes où les adparticules ont un environnement relativement homogène, alors que la diffusion chimique et la diffusion de transfert de masse sont plus fortement affectées par leurs environnements.
- La diffusion de traceur décrit le mouvement d'adparticules individuelles sur une surface à des niveaux relativement bas. À ces bas niveaux de couverture (<0,01 monocouche), les interactions entre particules sont faibles et chaque particules peuvent être considérer comme se déplaçant indépendamment des autres. La figure 1 représente un exemple de diffusion de traceur.
- La diffusion chimique décrit le processus à haut niveau de couverture, où les effets d'attractions et de répulsions entre adatomes deviennent important. Ces interactions modifient la mobilité des adatomes, car les adatomes voisins peuvent bloquer les sites d'adsorption adjacent, comme la figure 3 le montre.
- La diffusion intrinsèque a lieu sur une surface uniforme (par exemple, absence de marches ou de lacunes atomiques), comme une simple terrasse, où il n'y a ni pièges à adatomes, ni de sources. Ce régime est souvent étudié par la microscopie ionique, où la terrasse est un échantillon net, sur lequel une adaparticule diffuse. Même dans le cas d'une terrasse propre, le processus peut être influencé par la non-uniformité des coins de la terrasse.
- La diffusion de transfert de masse a lieu dans les cas où les adparticules sources et les pièges, comme les coins, les marches et les trous sont présents. Au lieu d'être seulement dépendante de la barrière de potentiel de saut Ediff, la diffusion est aussi maintenant dépendante de l'énergie de formation des adparticules mobiles. La nature de l'environnement de diffusion joue alors un rôle dans la vitesse de diffusion, puisque l'énergie de formation d'une adparticule est différente pour type de surface, comme le décrit le modèle terrace step kink.
Anisotropie
Les mécanismes et les coefficients de diffusion sont dépendants de l'anisotropie d'orientation suivant les différentes surfaces d'orientations, pour le matériau donné. Pour un solide cristallin, chaque plan de surface peut donner un phénomène de diffusion différent. Les surfaces d'empilement compact, telles que celle du cubique à faces centrées cfc (111) ont tendance à montrer des vitesses de diffusion plus grandes qu'une surface du même matériau telle que celle du cfc (100).[13],[14]
L'anisotropie de direction fait référence aux différences dans les vitesses ou les mécanismes de diffusion, mais en considérant cette fois une direction particulière d'un plan cristallographique donné. Ces différences peuvent être la conséquence d'anisotropie du réseau de surface, ou bien de la présence de marche sur la surface. L'un des plus surprenants exemples est l'anisotropie de direction lors des diffusions d'adatomes sur des surfaces telle que cfc (110), où la diffusion le long du canal est bien plus rapide que celle à travers le canal.
Mécanisme
 Figure 4. Modèle d'un mécanisme d'échange atomique entre un adatome (rose) et un atome de surface (gris) sur un réseau de surface carré (bleu). L'atome de surface devient un adatome et inversement.[1]
Figure 4. Modèle d'un mécanisme d'échange atomique entre un adatome (rose) et un atome de surface (gris) sur un réseau de surface carré (bleu). L'atome de surface devient un adatome et inversement.[1]
 Figure 5. Modèle d'un mécanisme de diffusion de lacune. Quand la couverture de surface est presque complète, ce mécanisme domine.[1]
Figure 5. Modèle d'un mécanisme de diffusion de lacune. Quand la couverture de surface est presque complète, ce mécanisme domine.[1]
Diffusion d'adatomes
La diffusion d'adatomes peut s'effectuer par différents mécanismes. La manière selon laquelle il diffuse est importante, car elle conditionne la cinétique du mouvement, la dépendance en température, la mobilité des espèces à la surface et quantité d'autres paramètres. Les mécanismes suivants comptent parmi les plus significatifs[15] :
- Le saut est le mécanisme le plus simple de diffusion. Dans ce modèle, les adatoms se trouvent dans des sites d'adsorption à la surface du réseau. Les mouvements surviennent lors de sauts successifs vers les sites adjacents. Les figures 1 et 3 montrent des adatomes diffusant par des processus de saut. Des études ont montré la présence de transitions métastables entre les sites d'adsorption, dans lesquels il est possible pour un adatome de rester temporairement.[16]
- L'échange atomique est caractérisé par l'échange entre un adatome et un atome adjacent à l'intérieur du réseau de surface. Comme sur la figure 4, après un échange atomique, l'adatome prend la place de l'atome de surface, et celui-ci a été déplacé et est devenu un adatome. Ce mécanisme peut avoir lieu lors de diffusion hétérogène (par exemple : des adatomes de Pt sur une surface de Ni), mais aussi lors d'auto-diffusion (adatome de Pt sur une surface de Pt). Il n'est pas encore défini d'un point de vue théorique pourquoi ce mécanisme est plus prédominant dans certains systèmes que les autres. Cependant lors d'échanges atomiques, le mécanisme peut être plus favorable énergétiquement qu'un simple saut d'un adatome.[17] Les théories actuelles s'orientent vers des possibilités multiples, comme la prise en compte de la contrainte de surface, de la relaxation de surface, et une stabilité accrue due au fait que les deux atomes doivent garder un haut niveau de coordination tout au long du mécanisme.[18]
- La diffusion à effet tunnel est la manifestation de l'effet tunnel impliquant des particules passant des barrières de diffusion. Ce mécanisme a lieu lorsque les particules diffusantes ont une masse faible, et la barrière de diffusion Ediff est faible.[19] À température suffisamment basse, il peut dominer sur le mécanisme classique de saut, et a été observé lors de la diffusion d'hydrogène sur des surfaces de tungstène W(110)[20], ou de cuivre Cu(100)[21]. Ce mécanisme est le seul, pour lequel le coefficient de diffusion est presque indépendant de la température.[22]
- La diffusion de lacune peut être le mécanisme de diffusion prédominant à haut niveau de couverture (voire même couverture complète). Il est assez difficile d'observer la diffusion de lacune, à cause des grands coefficients de diffusion et des concentrations de lacunes faibles.[23] La figure 5 illustre les idées simplifiées de ce mécanisme.
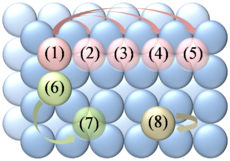 Figure 6. Mécanisme de saut de diffusion de surface. Diagramme de différents sauts qui peuvent avoir lieu sur des réseau carré comme le plan (100) de la maille cfc.
Figure 6. Mécanisme de saut de diffusion de surface. Diagramme de différents sauts qui peuvent avoir lieu sur des réseau carré comme le plan (100) de la maille cfc.
1) L'atome rose montre la réalisation de sauts de différentes longueurs vers les sites 2-5 ;
6) L'atome vert montre la réalisation d'un saut diagonal vers le site 7 ;
8) L'atome gris montre un saut de rebond : il revient au site de début.[24]
Les sauts vers les prochains sites les plus proches ont lieu de préférence à des fréquences plus grandes et des températures plus hautes.[1]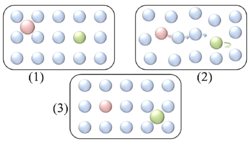 Figure 9. Mécanisme d'échange atomique à grande portée pour une diffusion sur un réseau carré. L'adatome rose qui est à la surface (1) provoque des perturbations dans les atomes environnant du réseau (2), ce qui a pour conséquence de faire sortir un atome du substrat (vert) (3).[1]
Figure 9. Mécanisme d'échange atomique à grande portée pour une diffusion sur un réseau carré. L'adatome rose qui est à la surface (1) provoque des perturbations dans les atomes environnant du réseau (2), ce qui a pour conséquence de faire sortir un atome du substrat (vert) (3).[1]
Les récents travaux aussi bien théoriques qu'expérimentaux effectués depuis les années 1970 ont révélé une grande variété de phénomènes de diffusion de surface en rapport avec les aspects mécanique et cinétique. Voici un résumé des plus remarquables :
- Les grands sauts sont ceux qui consistent au déplacement d'un adatome vers un site d'adsorption non voisin. Ils consiste alors en des sauts double, triple dans la même direction, [25] ou encore dans des directions différentes (figure 6). La théorie prédit qu'ils peuvent exister dans beaucoup de systèmes différents, et l'expérience a montré qu'ils ont lieu à des températures aussi basse que 0,1 Tm. Dans certains cas, les résultats indiquent que les grands sauts sont prédominants sur les sauts simples dans les diffusions de surface à température élevée. Les phénomènes de saut à longueur variable sont représentés par différentes distributions de déplacement atomique en fonction du temps (figure 7).[26]
- Les sauts de rebond ont lieu dans certains systèmes, comme l'ont montré les expériences et les simulations. Étant donné que le mouvement ne se traduit pas par un déplacement total (adatome revenant dans l'état initial), La preuve expérimentale des sauts de rebond vient aussi des interprétations statistiques des distributions atomiques. La figure 6 montre ce mécanisme.[24] Il a été montré expérimentalement que ces sauts n'ont lieu que dans le cas de diffusion à une dimension, sur des surfaces canalisées, en particulier, la surface cc (211) du tungstène.[27]
- La diffusion à canal transversal intervient sur des surfaces canalisées. La diffusion canalisée domine en raison d'une plus basse énergie de barrière pour ces mécanismes. Il y a été montré que la diffusion à canal transversal a lieu, comme décrit dans la figure 8. La position intermédiaire incertaine peut conduire à plusieurs possibilités de déplacement de l'adatome.[28]
- L'échange atomique à longue distance est un mécanisme entre un atome inséré dans une surface et un adatome, de manière similaire à un mécanisme d'échange atomique (figure 4). Cependant au lieu d'impliquer le plus proche voisin, il s'effectue avec un atome à longue distance (figure 9). Ce mécanisme a seulement été observé dans des simulations de dynamiques moléculaires, et doit maintenant être confirmé expérimentalement.[29]
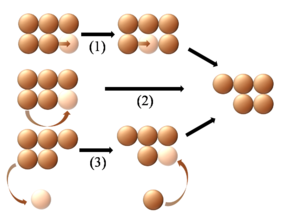 Figure 10. Mécanismes individuels de diffusion de surface d'agrégats.
Figure 10. Mécanismes individuels de diffusion de surface d'agrégats.
1) Déplacement séquantiel.
2) Diffusion de bordure.
3) Évaporation-condensation.
Dans ce modèle, ces trois mécanismes aboutissent au même déplacement final de cluster.[1]Diffusion d'agrégats
La diffusion d'agrégats consiste au mouvement d'agrégats atomiques ayant une taille comprise entre le dimère atomique à une « île » contenant des centaines d'atomes. Le mouvement d'agrégats peut se produire via le déplacement d'atomes individuels, de morceaux d'agrégats, ou de l'agrégat en entier.[30] Tous ces processus suppose un déplacement du centre de masse. Cette diffusion dépend fortement de la taille de l'agrégat, en effet les plus grands clusters présentent généralement une plus faible diffusion. Cependant cette tendance n'est pas toujours observée, comme par exemple, la diffusion de Rh sur une surface de Rh(100) qui présente une variation oscillatoire de l'énergie d'activation en fonction de la taille du cluster.[31] Dans ce cas certaine forme géométrique du cluster, qui dépendent du nombre d'atomes sont stables et ralentissent le processus de diffusion.
- Les mécanismes individuels sont ceux qui consistent au déplacement d'un atome à un temps donné.[32]
- La diffusion de bordure implique le mouvement d'adatomes ou de trou dans les bordures ou les décrochements. Comme le montre la figure 10, l'atome mobile se maintient à proximité tout au long du processus.
- L'évaporation-condensation suppose l'évaporation d'atome de l'agrégat sur la terrasse accompagné par la condensation d'un adatome de la terrasse sur l'agrégat, ce qui conduit à un changement du centre de masse de l'agrégat. Alors que la figure 10, montre que l'atome évaporé est le même que l'adatome condensé, il est possible que ce soit en fait deux atomes différents, le second pouvant venir du gaz.
- La diffusion saute-mouton est similaire à la diffusion de bordure, mais ici l'atome diffusant se déplace d'abord au sommet de l'agrégat avant de se déposer à un autre endroit qu'à l'origine.
- Le déplacement séquentiel se réfère au processus impliquant le mouvement d'un atome à un temps donné vers un site voisin libre.
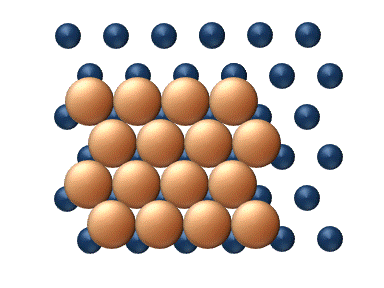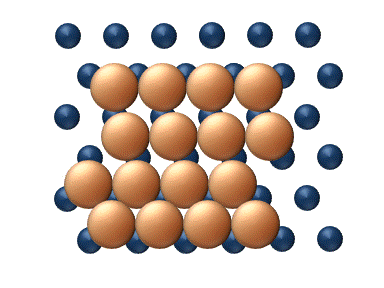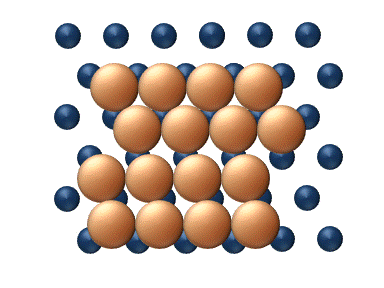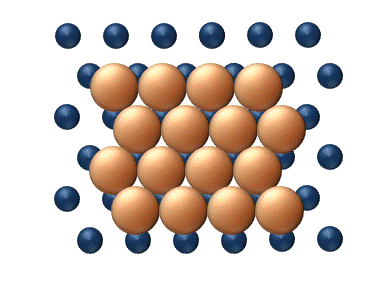
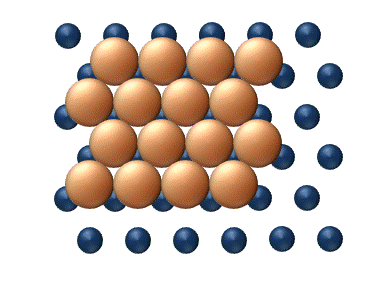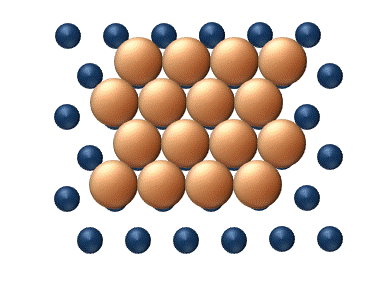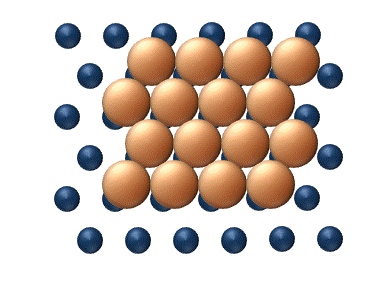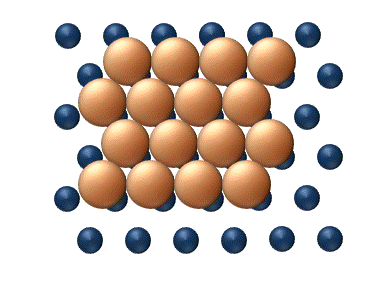
(a) Dislocation (b) Glissement 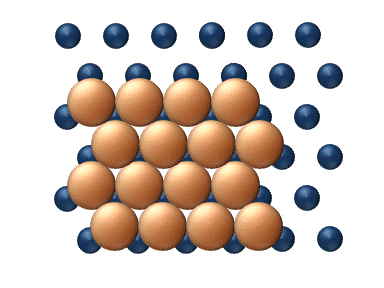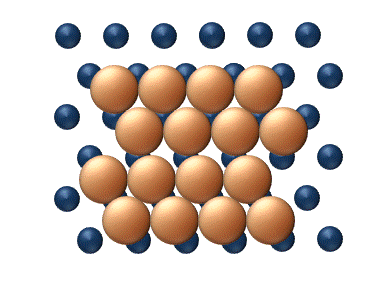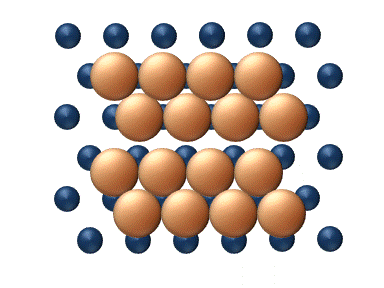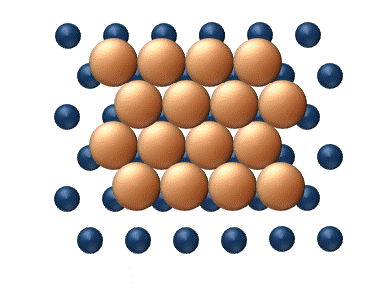
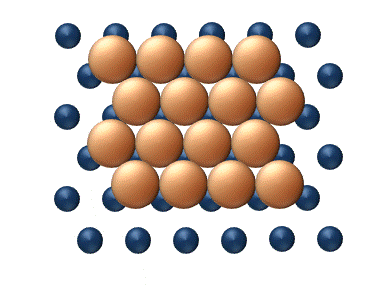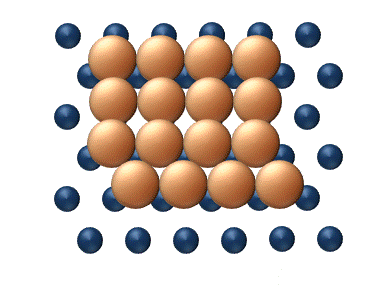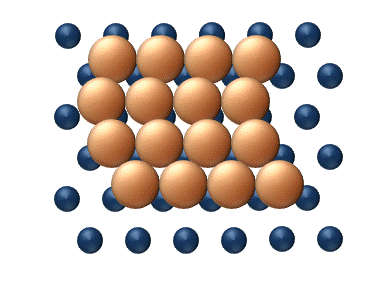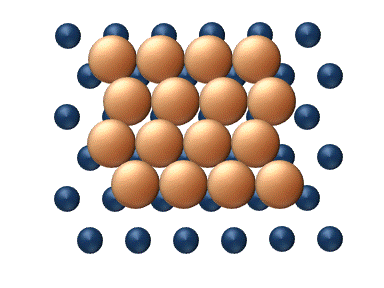
(c) Reptation (d) Cisaillement Figure 11. Mécanisme concerté de diffusion d'agrégats - Les mécanismes concertés correspondent à un mouvement soit des sections du cluster ou bien du cluster entier dans son ensemble.[33] Ces mécanismes peuvent être détaillé de la manière suivante :
- La diffusion par dislocation' intervient lorsque des sous-ensembles adjacent du cluster se déplacent rangée par rangée par l'intermédiaire du déplacement d'une dislocation, comme le montre la figure 11 (a).
- La diffusion par glissement se réfère au déplacement concerné d'un cluster entier (figure 11(b)).
- La reptation est un déplacement similaire à celui d'un serpent, impliquant des mouvements séquentiels de sections du cluster (figure 11(c)).
- Le Cisaillement' est le déplacement concerné d'un sous-ensemble du cluster à l'intérieur même du cluster (figure 11(d)).
Diffusion de surface et catalyse hétérogène
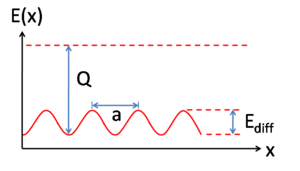
La diffusion superficielle est un concept important de la catalyse hétérogène, car les taux de réaction sont souvent déterminés par la capacité du réactant à « trouver » les autres réactants sur la surface. En augmentant la température, les molécules adsorbées, les fragments moléculaires, les atomes, et les agrégats tendent à avoir une plus grande mobilité (équation 1), mais la durée de vie de l'adsorption décroît car le facteur kBT devient assez pour que l'espèce adsorbée dépasse la barrière de désorption, Q (figure 2).
Aspect expérimentaux
La diffusion de surface peut être étudiée à l'aide de différentes techniques, les deux principes sont la microscopie ionique[5] et la microscope à effet tunnel.[34] En visualisant le déplacement des atomes ou des clusters avec le temps, il est alors possible d'obtenir les informations qualitative et quantitative sur la manière dont le processus de diffusion s'effectue. Afin d'obtenir des diffusions superficielles à l'échelle atomique, il est nécessaire de travailler sur des surfaces propres et dans des conditions de vide ultra poussé, ou bien avec des petites quantités de gaz inerte, comme c'est le cas en utilisant de l'hélium ou néon en microscopie ionique.
Notes et références
- ↑ a , b , c , d , e , f , g et h L'échelle spatiale et temporelle a été définie arbitrairement.
- ↑ a et b Oura 2003, p. 325
- ↑ (en) Ulrike Kürpick, « Self-diffusion on stepped Ir(111) surfaces », dans Phy. Rev. B, vol. 69, no 20, 2004 [résumé]
- ↑ G. Antczak, G. Ehrlich 2007, p. 39
- ↑ a et b En anglais field ion microscopy, abrégé FIM.
- ↑ Oura 2003, p. 349
- ↑ G. Antczak, G. Ehrlich 2007, p. 50, 59
- ↑ a et b Shustorovich 1991, p. 109
- ↑ Shustorovich 1991, p. 109-111
- ↑ Oura 2003, p. 327
- ↑ Oura 2003, p. 325-326
- ↑ Oura 2003, p. 330-333
- ↑ Oura 2003, p. 333
- ↑ Shustorovich 1991, p. 114-115
- ↑ Oura 2003, p. 336-340
- ↑ Shustorovich 1991, p. 111
- ↑ Oura 2003, p. 338
- ↑ G. Antczak, G. Ehrlich 2007, p. 48
- ↑ Oura 2003, p. 339
- ↑ (en) R. Gomer, « Diffusion of Adsorbates on Metal Surfaces », dans Rep. Prog. Phys., vol. 53, 1990, p. 917 [lien DOI]
- ↑ (en) « Direct Observation of the Quantum Tunneling of Single Hydrogen Atoms with a Scanning Tunneling Microscope », dans Phys. Rev. Lett., 2000, p. 661 [lien DOI]
- ↑ Shustorovich 1991, p. 115
- ↑ Oura 2003, p. 340-341
- ↑ a et b La figure est trompeuse, car les sauts de rebond ont plutôt lieu à une dimension.
- ↑ Ibach 2006, p. 496
- ↑ G. Antczak, G. Ehrlich 2007, p. 51
- ↑ G. Antczak, G. Ehrlich 2007, p. 58
- ↑ G. Antczak, G. Ehrlich 2007
- ↑ G. Antczak, G. Ehrlich 2007, p. 48-50
- ↑ Oura 2003, p. 341
- ↑ (en) G. L. Kellogg, « Atomic view of cluster diffusion on metal surfaces », dans Progress in Surface Science, vol. 53, 1999, p. 217 [lien DOI]
- ↑ Oura 2003, p. 343-344
- ↑ Oura 2003, p. 343-345
- ↑ Oura 2003, p. 349
Voir aussi
Articles connexes
Bibliographie
- (en) G. Antczak, G. Ehrlich, « Jump processes in surface diffusion », dans Surface Science Reports, vol. 62, 2007, p. 39-61 [résumé]
- (en) V.G. Lifshits, A.A. Saranin, A.V. Zotov, M. Katayama, Surface science : an introduction, 2003 [détail des éditions]
- (en) E. Shustorovich, Metal-Surface Reaction Energetics: Theory and Applications to Heterogeneous Catalysis, Chemisorption, and Surface Diffusion, VCH Publishers, Inc., 1991 (ISBN 3-527-27938-5)
- (en) D. Spanjaard, Concepts in surface physics, Springer, 1993, 565 p.
- (en) H. Ibach, Physics of surfaces and interfaces, Springer, 2006, 646 p. (ISBN 3-540-34709-7)
- Portail de la physique
Catégorie : Physico-chimie des interfaces
Wikimedia Foundation. 2010.