- Acide trifluoroacétique
-
Acide trifluoroacétique 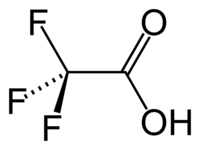
Général Nom IUPAC Acide trifluoroacétique Synonymes Acide perfluoroacétique
Acide trifluoroéthanoïque
TFANo CAS No EINECS No RTECS SMILES Apparence liquide incolore Propriétés chimiques Formule brute C2HF3O2 [Isomères] Masse molaire[3] 114,0233 ± 0,0023 g·mol-1
C 21,07 %, H 0,88 %, F 49,99 %, O 28,06 %,pKa 0,3 Moment dipolaire 2,28 ± 0,25 D [1] Diamètre moléculaire 0,492 nm [2] Propriétés physiques T° fusion 257,8 K (-15,4 °C) sous 1 bar T° ébullition 345,6 K (72,4 °C) sous 1 bar Solubilité miscible dans l'eau Masse volumique 1,5351 (20 °C) Pression de vapeur saturante 141 hPa (20 °C) Point critique 32,6 bar, 218,15 °C [4] Thermochimie Cp Propriétés électroniques 1re énergie d'ionisation 11,46 eV (gaz)[6] Propriétés optiques Indice de réfraction  1,2850 [2]
1,2850 [2]Précautions Directive 67/548/EEC 
CPhrases R : 20, 35, 52/53, Phrases S : (1/2), 9, 26, 27, 28, 45, 61, NFPA 704 SIMDUT[7] Produit non classifié SGH[8] 
DangerComposés apparentés Anions apparentés CH3COOH
CCl3COOHUnités du SI & CNTP, sauf indication contraire. L'acide trifluoroacétique (TFA) est un composé chimique de formule CF3COOH. C'est un acide carboxylique fort en raison de la présence de trois atomes de fluor, fortement électronégatifs. Comparé à l'acide acétique, l'acide trifluoroacétique est environ 100 000 fois plus puissant. Cet acide est très utilisé en chimie organique.
Sommaire
Utilisation
Le TFA est un réactif utilisé fréquemment en synthèse organique en raison de la combinaison de propriétés intéressantes : volatilité, solubilité dans des solvants organiques et force[9]. Il est aussi moins oxydant que l'acide sulfurique mais plus facilement obtenu sous forme anhydre que par exemple l'acide chlorhydrique. Une des complications pour son utilisation est que le TFA forme un azéotrope avec l'eau avec un point d'ébullition à 105 °C (soit 378 K).
Le TFA est aussi utilisé fréquemment comme tampon en chromatographie liquide pour la séparation des composés organiques, et particulièrement des peptides et des petites protéines. C'est un solvant versatile pour la spectroscopie RMN.
L'anhydre dérivé, [CF3C(O)]2O, est un réactif commun pour l'introduction du groupe trifluoroacétyle.Synthèse
L'électrofluoration de l'acide acétique au moyen de la méthode de Simmons est la meilleure manière d'obtenir l'acide trifluoroacétique. La réaction à l'anode durant l'électrolyse d'un mélange d'un fluorure d'hydrogène et de l'acide acétique au-dessous duquel le fluor élémentaire (F2) se crée est une réaction douce qui laisse le groupe carboxylique intact.
Références
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 0-88415-857-8, ISBN 978-0-88415-858-5, ISBN 978-0-88415-859-2)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Acide trifluoroacétique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Eidman, K. F.; Nichols, P. J. "Trifluoroacetic Acid" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289
Source
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Trifluoroacetic acid » (voir la liste des auteurs)
Catégories :- Produit chimique corrosif
- Produit chimique dangereux pour l'environnement
- Acide carboxylique
- Composé trifluorométhylé
Wikimedia Foundation. 2010.