- Chlorure d’éthyle
-
Chloroéthane
Chloroéthane 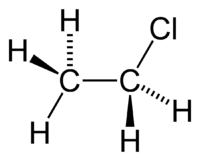
Général Nom IUPAC Chloroéthane Synonymes Chlorure d'éthyle
MonochloroéthaneNo CAS No EINECS Apparence gaz comprimé liquefié incolore, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C2H5Cl [Isomères] Masse molaire 64,514 g∙mol-1
C 37,23 %, H 7,81 %, Cl 54,95 %,Moment dipolaire 2,06 D Propriétés physiques T° fusion -138 °C[1] T° ébullition 12,5 °C[1] Solubilité dans l'eau à 20 °C : 0.574 g/100 ml[1] Masse volumique (eau = 1) : 0.918[1] T° d’auto-inflammation 519 °C[1] Point d’éclair -50 °C c.f.[1] Limites d’explosivité dans l’air en volume % dans l'air : 3.6-14.8[1] Pression de vapeur saturante à 20 °C : 133.3 kPa[1] Point critique 187,2 °C; 52.4bar[2] Point triple -138,3 °C Thermochimie ΔfH0gaz -112,3 kJ/mol[3] Cp 103.3 J/mol.K (liquide)[4] Précautions Directive 67/548/EEC 
Xn
F+Phrases R : 12, 40, 52/53, Phrases S : (2), 9, 16, 33, 36/37, 61, Transport - 1037 NFPA 704 SIMDUT[6] 

SGH[7] 


DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[5] Écotoxicologie LogP 1.54[1] Unités du SI & CNTP, sauf indication contraire. Le chloroéthane ou monochloroéthane, généralement connu par son ancienne appellation chlorure éthylique, est un composé chimique autrefois employé couramment pour produire le plomb tétraéthyle, un additif pour le carburant. C'est un gaz incolore et inflammable, avec une odeur légère et douce.
C’est aussi un fluide frigorigène.
Sommaire
Utilisation
- réactif dans la synthèse du plomb tétraethyle : à partir des années 20 et pendant la majeure partie du vingtième siècle, le chlorure d'éthyle a été massivement utilisé pour la synthèse du principal additif de l'essence plombée. Après le retrait progressif des carburants au plomb entre 1976 et 2000, la production de chlorure d'éthyle a fortement chuté.
- liquide réfrigérant
- liquide propulseur dans les flacons d'aérosol et comme agent d'entraînement des mousses polymérisables.
- anesthésiant local : appliqué directement sur la peau sous forme de spray, il produit en s'évaporant une baisse rapide de température qui insensibilise momentanément la zone traitée. On l'utilise par exemple pour calmer la douleur à la suite de piqûre d'insecte ou pour une petite chirurgie locale. Il n'est en revanche pas utilisé en anesthésie générale en raison de sa toxicité.
- solvant des corps gras, des résines, du soufre, du phosphore.
- agent éthylant dans la synthèse de certains colorants, de médicaments et à plus grande échelle pour la préparation de l'éthylcellulose qui est un épaississant et un liant utilisé dans les peintures et les cosmétiques.
Production et synthèse
Le chloroéthane est le produit de la réaction entre l'éthylène et le chlorure d'hydrogène avec un catalyseur de chlorure d'aluminium à des températures comprises entre 130 °C et 250 °C. Dans ces conditions, le chloroéthane est produit selon l'équation chimique :
Autrefois, le chlorure d'éthyle était également produit à partir de l'éthanol et de l'acide chlorhydrique, ou à partir de l'éthane et du chlore, mais ces procédés ne sont pas rentables. Une certaine quantité de chlorure d'éthyle est issue de la production du polychlorure de vinyle.
Sécurité
Sécurité incendie
C'est un produit extrêmement inflammable avec émission de gaz et fumées toxiques et irritants (chlorure d'hydrogène, phosgène notamment).
Toxicité
Le chlorure d'éthyle est le moins toxique des chloroéthanes. Comme les autres hydrocarbures chlorés, il agit sur le système nerveux central mais dans un moindre mesure que d'autres composés similaires. L'inhalation de vapeurs à une concentration inférieur à 1% ne donne généralement lieu à aucun symptôme. A une concentration plus élévée on observe des symptômes voisins de ceux que procure une intoxication éthylique. Au delà d'une concentration supérieure à 15%, l'exposition entraîne une perte de conscience, des désordres du fonctionnement cardiaque et peut s'avérer fatale.
References
- ↑ a , b , c , d , e , f , g , h , i et j CHLOROETHANE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Berthoud, A., Determination of Critical Temperatures and Pressures of Amines and Alkyl Chlorides, J. Chim. Phys. Phys.-Chim. Biol., 1917, 15, 3.
- ↑ Fletcher, R.A.; Pilcher, G., Measurements of heats of combustion by flame calorimetry. Part 7.-Chloromethane, chloroethane, 1-chloropropane, 2-chloropropane, Trans. Faraday Soc., 1971, 67, 3191-3201.
- ↑ Gordon, J.; Giauque, W.F., The entropy of ethyl chloride. Heat capacity from 18 to 287K. Vapor pressure. Heats of fusion and vaporization, J. Am. Chem. Soc., 1948, 70, 1506-1510.
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Chloroéthane » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Liens externes
- Portail de la chimie
Catégories : Produit chimique nocif | Produit chimique extrêmement inflammable | Produit chimique dangereux pour l'environnement | Réfrigérant | Chloroalcane
Wikimedia Foundation. 2010.

