- 7803-51-2
-
Phosphine
Phosphine 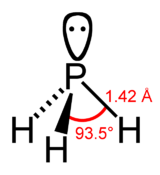
Structure de la phosphine Général Nom IUPAC Phosphane (IUPAC)
Phosphine
Hydrure de phosphore
Hydrogène phosphoréNo CAS No EINECS Apparence gaz comprime liquefie incolore.[1] Propriétés chimiques Formule brute PH3 Masse molaire 33,99758 g∙mol-1
H 8,89 %, P 91,11 %,Propriétés physiques T° fusion -133 °C[1] T° ébullition -87,7 °C[1] Solubilité dans l'eau à 17 °C : 26 ml/100 ml[1] Masse volumique (eau = 1) : 0.8[1] T° d’auto-inflammation 38 °C[1] Point d’éclair Gaz Inflammable[1] Limites d’explosivité dans l’air en volume % dans l'air : 1.8-?[1] Pression de vapeur saturante à 20 °C : 4186 kPa[1] Précautions Directive 67/548/EEC 
T+
F+
NPhrases R : 12, 17, 26, 34, 50, Phrases S : 1/2, 28, 36/37, 45, 61, [2] Transport 263 2199 [3]NFPA 704 SIMDUT[4] 


SGH[5] 




DangerUnités du SI & CNTP, sauf indication contraire. La phosphine est le nom commun de l'hydrure de phosphore (nom IUPAC : phosphane).
Il s'agit d'un gaz incolore et inflammable. Son point d'ébullition est de -88 °C à 1 atm. La phosphine pure est inodore, mais la « phosphine technique » a une odeur extrêmement déplaisante évoquant l'ail ou le poisson pourri, à cause de la présence de phosphine substituée et de diphosphine (P2H4).
Sa formule est PH3. Elle peut être le résultat d'un sel de phosphure d'aluminium ou de magnésium, par exemple, qui aurait réagi avec un acide ou tout simplement avec l'eau où il est hydrolysé.
Exemple :AlP+ 3H2O --> PH3 + Al(OH)3
phosphure d'aluminium + eau --> phosphine (gaz) + hydroxyde d'aluminium.
Sommaire
Utilisation
- Rodenticide utilisé pour tuer des taupes ou autres vermines.
- Dopant dans l'industrie des semi-conducteurs.
- Destruction des insectes et des acariens dans les denrées et semences stockées (fûts, silos, bateaux etc)
Précautions
Les sels de phosphure d'aluminium et de tous autres métaux, doivent être placés de telle façon à ce qu'ils n'aient pas accès à de l'humidité ambiante, de l'eau ou un acide ! Le produit ne peut être appliqué que par des entreprises et du personnel agréé et sous le contrôle des services de la protection des végétaux.
Structure et propriétés
Historique
Chimie
La phosphine peut être préparée de différentes manières. Industriellement, elle s'obtient par réaction du phosphore blanc avec l'hydroxyde de sodium, formant par la même réaction du sodium. Elle peut s'obtenir par hydrolyse d'un phosphure métallique comme le phosphure d'aluminium ou le phosphure de calcium.
La phosphine pure PH3, sans trace de phosphène P2H4, peut s'obtenir par action de l'hydroxyde de potassium sur l'iodure de phosphonium (PH4I)
On appelle aussi "phosphines" les dérivés de PH3. Ceux-ci sont des dérivés alkylés ou arylés, tout comme les amines sont des dérivés de l'ammoniac. Parmi les exemples courants, la triphénylphosphine ((C6H5)3P) et le BINAP, sont toutes deux utilisées comme ligands dans des complexes métalliques (catalyseur de Wilkinson). De telles phosphines sont souvent présentées comme co-catalyseurs dans des réaction telles que le couplage de Sonogashira.
Ne pas confondre la "phosphine" avec le "phosgène" (COCl2) qui ne contient pas de phosphore.
Utilisation comme agent fumigène
Article connexe
Lien externe
Références
- E. Fluck, The chemistry of phosphine, Topics in Current Chemistry Vol. 35, 64 pp, 1973.
- A.D.F. Toy, The Chemistry of Phosphorus, Pergamon Press, Oxford, UK, 1973.
- WHO (World Health Organisation), Phosphine and selected metal phosphides, Environmental Health Criteria. Published under the joint sponsorship of UNEP, ILO and WHO, Geneva, Vol. 73, 100 pp, 1988.
- ↑ a , b , c , d , e , f , g , h et i PHOSPHINE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « phosphine » sur ESIS, consulté le 11 février 2009
- ↑ Entrée du numéro CAS « 7803-51-2 » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 novembre 2008 (JavaScript nécessaire)
- ↑ « Phosphine » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Composé du phosphore | Produit chimique très toxique | Produit chimique extrêmement inflammable | Produit chimique dangereux pour l'environnement | Produit chimique corrosif | Hydrure
Wikimedia Foundation. 2010.