- 7772-98-7
-
Thiosulfate de sodium
Thiosulfate de sodium 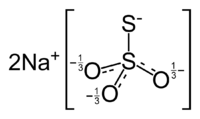
Général No CAS No EINECS No E E539 Apparence Poudre blanche Propriétés chimiques Formule brute Na2S2O3 Masse molaire 158,108 g∙mol-1
Na 29,08 %, O 30,36 %, S 40,56 %,Propriétés physiques Solubilité 700 g/L à 20 °C
2 450 g/L à 80 °CMasse volumique 1,667.10³ kg/m³ (solide) Précautions Directive 67/548/EEC[1] Phrases R : 36, 37, 38, Phrases S : 26, 36, SIMDUT[2] Produit non contrôlé Unités du SI & CNTP, sauf indication contraire. Sommaire
Usages
Le thiosulfate de sodium (Sodium thiosulfate appelé anciennement hyposulfite de sodium), de formule Na2S2O3, 5H2O, est un agent fixateur, également utilisé pour neutraliser l'effet de biocides tels que le chlore, l'iode ou le brome, voire d'autres oxydants.
Il est également utilisé en photographie pour la réalisation de bains de fixateur et dans les laboratoires pour titrer l'eau de javel.
Histoire
Lors de la Première Guerre mondiale, des compresses ou capuches de tissus imbibés de ce produit ont servi à neutraliser les premiers gaz de combat, dont le chlore, la difficulté étant de se procurer dans les tranchées des quantités suffisantes de ce produit.
Propriétés
La solvatation du thiosulfate de sodium dans l'eau provoque une réaction endothermique, ce qui signifie que la température du solvant diminuera.
Risques & dangers
il se décompose sous l'action de la chaleur à partir de 45 °C et peut réagir vivement en présence de nitrites et peroxydes (risque d'explosion). En présence d'acides, il peut y avoir formation d'oxydes de soufre dangereux[3].
Voir aussi
Liens externes
Notes et références
- ↑ Fiche sécurité
- ↑ « Thiosulfate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Fiche sécurité
- Portail de la chimie
- Portail de la photographie
Catégories : Composé du sodium | Sulfate | Composé du soufre
Wikimedia Foundation. 2010.
