- CH3CH2COOH
-
Acide propanoïque
Acide propanoïque 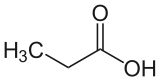
Général Nom IUPAC Acide propanoïque Synonymes acide propionique
Acide éthylformique
Acide méthylacétiqueNo CAS No EINECS No E E280 FEMA SMILES InChI Apparence liquide incolore, huileux, d'odeur âcre.[1] Propriétés chimiques Formule brute C3H6O2 [Isomères] Masse molaire 74,0785 g∙mol-1
C 48,64 %, H 8,16 %, O 43,2 %,pKa 4,87 Propriétés physiques T° fusion -21 °C[1] T° ébullition 141 °C[1] Solubilité dans l'eau : très bonne[1] Masse volumique (eau = 1) : 0.99[1] T° d’auto-inflammation 485 °C[1] Point d’éclair 54 °C (c.f.); 57 °C (c.o.)[1] Limites d’explosivité dans l’air en volume % dans l'air : 2.1-12[1] Pression de vapeur saturante à 20 °C : 390 Pa[1] Viscosité dynamique 1.10-3 Pa.s Propriétés optiques Indice de réfraction 1,397 Précautions Directive 67/548/EEC 
CPhrases R : 34, Phrases S : (1/2), 23, 36, 45, Transport 80 1848 NFPA 704 SIMDUT[2] 


SGH[3] 
DangerÉcotoxicologie LogP 0.33[1] Unités du SI & CNTP, sauf indication contraire. L'acide propanoïque ou acide propionique (venant du grec "pion" voulant dire "gras") est un acide carboxylique saturé à 3 atomes de carbone.
Sommaire
Historique
Cet acide a été découvert par Johann Gottlieb en 1844 dans les produits de dégradation du sucre. Peu de temps après il a été synthétisé par d'autres voies par des chimistes qui n'ont pas fait tout de suite le lien. C'est le français Jean-Baptiste Dumas qui a mis en relation ces produits baptisant l'acide nouvellement caractérisé acide propionique (du grec protos=premier et pion=gras) en référence à sa particularité de plus léger des acides gras, c'est à dire capable de donner du savon par saponification.
Description
Cet acide se présente sous la forme d'un liquide incolore, corrosif et à l'odeur désagréable. Il est miscible à l'eau mais peut être relargué par simple ajout de sel. A l'état gazeux il présente un point commun avec ses homologues plus légers à savoir une forte entorse à la loi des gaz parfaits; en effet il reste à l'état de dimère lié par liaison hydrogène en phase gazeuse. Il a les propriétés communes à tous les acides carboxyliques comme la possibilité de former des amines, esters, anhydride et autres halogénures d'acyles. Il peut aussi subir une halogénation de Hell-Volhard-Zelinsky qui consiste en une α-halogénation par le brome en présence de PBr3.
Production
La production industrielle d'acide propionique se fait par oxydation de propanal. La présence de catalyseur à base de cobalt ou de manganèse rend la réaction rapide même à température ambiante. En pratique on travaille entre 40 et 50 °C. L'équation de la réaction est:
CH3CH2CHO + 1/2 O2 → CH3CH2COOH Il y a aussi une autre filière de production de cet acide comme sous-produit de la synthèse d'acide acétique. Autrefois importante, cette filière est devenue mineure dans la production d'acide. Le plus gros producteur d'acide est BASF.
Utilisations
Cet acide est un intermédiaire chimique très utile. On s'en sert pour modifier les fibres de cellulose synthétique. Il intervient dans la synthèse de médicaments. Enfin des esters de cet acide sont utilisés comme solvant ou comme intermédiaire dans la synthèse de composant de parfum ou d'arôme.
L'acide propionique en biologie
Notes et références de l'article
- ↑ a , b , c , d , e , f , g , h , i et j ACIDE PROPIONIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Acide propionique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Voir aussi
Articles connexes
Liens et documents externes
- Portail de la chimie
Catégories : Produit chimique corrosif | Acide carboxylique | Agent conservateur | Arôme
Wikimedia Foundation. 2010.


