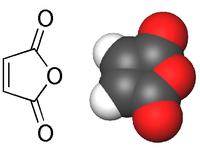
C4H2O3
- C4H2O3
-
Anhydride maléique
| Anhydride maléique |
 |
| Général |
| Nom IUPAC |
anhydride cis-butènedioïque |
| Synonymes |
2,5-Furanedione
|
| No CAS |
108-31-6 |
| No EINECS |
203-571-6 |
| SMILES |
|
| InChI |
InChI=1/C4H2O3/c5-3-1-2-4(6)7-3/h1-2H
|
| Apparence |
cristaux incolores ou blancs, d'odeur âcre.[1] |
| Propriétés chimiques |
| Formule brute |
C4H2O3 [Isomères]
|
| Masse molaire |
98,0569 g∙mol-1
C 48,99 %, H 2,06 %, O 48,95 %,
|
| Propriétés physiques |
| T° fusion |
53 °C[1] |
| T° ébullition |
202 °C[1] |
| Solubilité |
dans l'eau : 40 g/100 ml[1] |
| Masse volumique |
1,5[1],
1,3 (liquide à 70 °C) |
| T° d’auto-inflammation |
475 °C[1] |
| Point d’éclair |
102 °C (c.f.)[1] |
| Limites d’explosivité dans l’air |
en volume % dans l'air : 1.4-7.1[1] |
| Pression de vapeur saturante |
20 Pa à 20 °C
25 Pa à 25 °C
45 Pa à 30 °C
200 Pa à 50 °C |
| Précautions |
|
Directive 67/548/EEC
|

C
|
|
Numéro index :
607-096-00-9
Symboles :
C : Corrosif
Phrases R :
R22 : Nocif en cas d’ ingestion.
R34 : Provoque des brûlures.
R42/43 : Peut entraîner une sensibilisation par inhalation et par contact avec la peau.
Phrases S :
(S2) : Conserver hors de portée des enfants.
S22 : Ne pas respirer les poussières.
S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’ eau et consulter un spécialiste.
S45 : En cas d’ accident ou de malaise, consulter immédiatement un médecin ( si possible, lui montrer l’ étiquette).
S36/37/39 : Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux/ du visage.
|
| Phrases R : 22, 34, 42/43, |
| Phrases S : (2), 22, 26, 36/37/39, 45, |
|
Transport
|
Code Kemler :
80 : matière corrosive ou présentant un degré mineur de corrosivité
Numéro ONU :
2215 : ANHYDRIDE MALÉIQUE
Code de classification :

8 : Matières corrosives
|
|
NFPA 704
|
|
|
|
SIMDUT[2]
|
  D1B, D2A, D2B, E,
D1B, D2A, D2B, E,
D1B : Matière toxique ayant des effets immédiats graves
létalité aiguë : DL50 orale (cochon d'inde) = 390 mg/kg
D2A : Matière très toxique ayant d'autres effets toxiques
sensibilisation des voies respiratoires chez l'humain
D2B : Matière toxique ayant d'autres effets toxiques
10
sensibilisation de la peau chez l'animal
E : Matière corrosive
Transport des marchandises dangereuses : classe 8
Divulgation à 0,1% selon la liste de divulgation des ingrédients
|
|
SGH[3]
|
 
Danger
H302, H314, H317, H334,
H302 : Nocif en cas d'ingestion
H314 : Provoque de graves brûlures de la peau et des lésions oculaires
H317 : Peut provoquer une allergie cutanée
H334 : Peut provoquer des symptômes allergiques ou d'asthme ou des difficultés respiratoires par inhalation
|
|
Unités du SI & CNTP, sauf indication contraire.
|
L'anhydride maléique (anhydride cis-butènedioïque) est l'anhydride de l'acide maléique (acide carboxylique):
Il se présente généralement sous la forme de cristaux blancs à transparents.
Production et synthèse
Comme son nom l'indique, l'anhydride maléique peut être obtenu par déshydratation de l'acide maléique (hydraté, il donne l'acide maléique). Il a longtemps été synthétisé par oxydation du benzène ou d'autres composés aromatiques. De par l'augmentation ces dernières années du prix du benzène (et de par sa toxicité), il est aujourd'hui majoritairement synthétisé par oxydation du butane :
2 CH3CH2CH2CH3 + 7 O2 → 2 C2H2(CO)2O + 8 H2O
Utilisation
L'anhydride maléique possède plusieurs propriétés chimiques remarquables dues aux fonctions qu'il présente. Il est entre autres utilisé :
- Pour obtenir l'acide maléique par hydratation. En utilisant à la place de l'eau un alcool, un ester peut être obtenu.
- Comme diénophile dans la réaction de Diels-Alder.
- Comme liguant dans des complexes métalliques (Pt(PPh3)2(AM) ou Fe(CO)4(AM))
Liens externes
Références
 Portail de la chimie
Portail de la chimie
Catégories : Produit chimique corrosif | Anhydride d'acide
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article C4H2O3 de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
Maleic anhydride — Maleic anhydride[1] … Wikipedia
maleic anhydride — noun : a crystalline cyclic acid anhydride C4H2O3 that gives rise to maleic acid on reaction with water, that reacts readily with dienes in the Diels Alder reaction, and that is used chiefly in the manufacture of alkyd and other resins and in the … Useful english dictionary
Moniliformin — IUPAC name sodium 3,4 dioxo 1 cyclobutenolate … Wikipedia
108-31-6 — Anhydride maléique Anhydride maléique Général Nom IUPAC anhydride cis butènedioïque Sy … Wikipédia en Français
Anhydride maleique — Anhydride maléique Anhydride maléique Général Nom IUPAC anhydride cis butènedioïque Sy … Wikipédia en Français
Anhydride maléique — Général Nom IUPAC anhydride cis butènedioïque Synonymes … Wikipédia en Français
Anhydride maléïque — Anhydride maléique Anhydride maléique Général Nom IUPAC anhydride cis butènedioïque Sy … Wikipédia en Français
Малеиновый ангидрид — Малеиновый ангидрид … Википедия
maléique — ● maléique adjectif Acide maléique, acide butènedioïque Z (ou cis), HOCO―CH≅CH―COOH, stéréo isomère de l acide fumarique. Anhydride maléique, anhydride C4H2O3 de l acide maléique. (Obtenu par oxydation ménagée du benzène, l anhydride maléique est … Encyclopédie Universelle
maleic anhydride — noun Date: 1857 a caustic crystalline cyclic anhydride C4H2O3 used especially in making resins … New Collegiate Dictionary