- 108-31-6
-
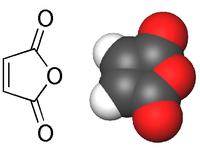
Anhydride maléique
Anhydride maléique Général Nom IUPAC anhydride cis-butènedioïque Synonymes 2,5-Furanedione No CAS No EINECS SMILES InChI Apparence cristaux incolores ou blancs, d'odeur âcre.[1] Propriétés chimiques Formule brute C4H2O3 [Isomères] Masse molaire 98,0569 g∙mol-1
C 48,99 %, H 2,06 %, O 48,95 %,Propriétés physiques T° fusion 53 °C[1] T° ébullition 202 °C[1] Solubilité dans l'eau : 40 g/100 ml[1] Masse volumique 1,5[1],
1,3 (liquide à 70 °C)T° d’auto-inflammation 475 °C[1] Point d’éclair 102 °C (c.f.)[1] Limites d’explosivité dans l’air en volume % dans l'air : 1.4-7.1[1] Pression de vapeur saturante 20 Pa à 20 °C
25 Pa à 25 °C
45 Pa à 30 °C
200 Pa à 50 °CPrécautions Directive 67/548/EEC 
CPhrases R : 22, 34, 42/43, Phrases S : (2), 22, 26, 36/37/39, 45, Transport 80 2215 NFPA 704 SIMDUT[2] 

SGH[3] 

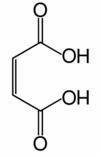
DangerUnités du SI & CNTP, sauf indication contraire. L'anhydride maléique (anhydride cis-butènedioïque) est l'anhydride de l'acide maléique (acide carboxylique):
Il se présente généralement sous la forme de cristaux blancs à transparents.
Sommaire
Production et synthèse
Comme son nom l'indique, l'anhydride maléique peut être obtenu par déshydratation de l'acide maléique (hydraté, il donne l'acide maléique). Il a longtemps été synthétisé par oxydation du benzène ou d'autres composés aromatiques. De par l'augmentation ces dernières années du prix du benzène (et de par sa toxicité), il est aujourd'hui majoritairement synthétisé par oxydation du butane :
2 CH3CH2CH2CH3 + 7 O2 → 2 C2H2(CO)2O + 8 H2O Utilisation
L'anhydride maléique possède plusieurs propriétés chimiques remarquables dues aux fonctions qu'il présente. Il est entre autres utilisé :
- Pour obtenir l'acide maléique par hydratation. En utilisant à la place de l'eau un alcool, un ester peut être obtenu.
- Comme diénophile dans la réaction de Diels-Alder.
- Comme liguant dans des complexes métalliques (Pt(PPh3)2(AM) ou Fe(CO)4(AM))
Liens externes
Références
- ↑ a , b , c , d , e , f , g et h ANHYDRIDE MALEIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Anhydride maléique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Produit chimique corrosif | Anhydride d'acide
Wikimedia Foundation. 2010.