- C2Cl2O2
-
Chlorure d'oxalyle
Chlorure d'oxalyle 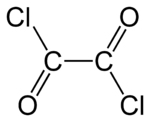
Chlorure d'oxalyle Général Nom IUPAC dichlorure d'éthanedioyle No CAS No EINECS SMILES Apparence liquide incolore fumant, odeur pénétrante Propriétés chimiques Formule brute C2Cl2O2 [Isomères] Masse molaire 126,926 g∙mol-1
C 18,93 %, Cl 55,86 %, O 25,21 %,Propriétés physiques T° fusion -16 °C T° ébullition 63 à 64 °C (1,017 bar) Solubilité Décomposition violente
dans l'eau et l'alcool.
Soluble dans
l'éther diéthylique,
le disulfure de carbone,
le chloroforme,
le tétrachlorure de carbone,
le benzèneMasse volumique 1,4785 Propriétés optiques Indice de réfraction 1,429 à 13 °C Précautions Directive 67/548/EEC 
TPhrases R : 14, 23, 29, 34, 37, Phrases S : 26, 36/37/39, 45, Unités du SI & CNTP, sauf indication contraire. Le chlorure d'oxalyle est un composé chimique organique de formule (COCl)2. Il appartient à la famille des halogénures d'acyle, dérivé d'un diacide appelé acide oxalique.
Sommaire
Utilisations
Réactif d'oxydation
Le chlorure d'oxalyle est un des réactifs utilisés pour l'oxydation de Swern, une oxydation douce des alcools en aldéhydes ou cétones.
Estérification
Tout comme les autres chlorures d'acyles, le chlorure d'oxaylyle réagit avec les alcools pour produire des esters :
- 2 RCH2OH + (COCl)2 → RCH2OC(O)C(O)OCH2R + 2 HCl
Synthèse de chlorures d'acyle
C'est un des réactifs permettant en synthèse organique de préparer des chlorures d'acyles à partir des acides carboxyliques correspondants. Comme avec le chlorure de thionyle SOCl2, la réaction est fortement favorisée par l'évaporation des produits qui sont gazeux aux pression et température normales :
- RCO2H + (COCl)2 → RCOCl + HCl + CO + CO2
Le chlorure d'oxalyle tend à être plus doux, plus sélectif que d'autres agents de chloration.
Friedel-Craft
Le chlorure d'oxalyle réagit avec les cycles aromatiques comme le benzène en présence de chlorure d'aluminium en tant que catalyseur pour produire des chlorures d'acyle aromatiques, par réaction de Friedel-Crafts[1],[2]. Le chlorure d'acyle obtenu peut être hydrolysé pour former l'acide carboxylique correspondant.
Préparation
Préparé à partir de l'acide oxalique et du pentachlorure de phosphore (PCl5).
Précautions
Comme tous les halogénures d'acyle, le chlorure d'oxalyle réagit avec l'eau en libérant de l'acide halohydrique. Ses effets sont comparables à ceux du phosgène.
En Mars 2000, un Airbus A330 de Malaysia Airlines a été irrémédiablement endommagé après une fausse déclaration de marchandises : du chlorure d'oxalyle avait fui dans sa soute[3].Notes et références
- ↑ Neubert, M. E.; Fishel, D. L. (1990). "Preparation of 4-Alkyl- and 4-Halobenzoyl Chlorides: 4-Pentylbenzoyl Chloride". Org. Synth.; Coll. Vol. 7: 420.
- ↑ Sokol, P. E. (1973). "Mesitoic Acid". Org. Synth.; Coll. Vol. 5: 706.
- ↑ Firm told to pay $65 mln for ruining plane, Reuters (2007-12-06). Consulté le 2007-12-06.
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique corrosif | Réactif pour la chimie organique | Chlorure d'acyle
Wikimedia Foundation. 2010.
