- Synthèse de Bartoli de l'indole
-
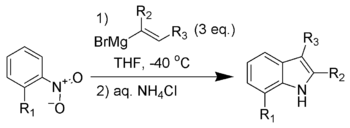
La synthèse de Bartoli de l'indole (appelée aussi réaction de Bartoli) est une série de réactions organiques à partir d'un nitrobenzène ortho-substituté et d'organomagnésien vinyle pour former des indoles substitués[1],[2],[3],[4].
Cette réaction ne fonctionne qu'avec un nitrobenzène substitué en position ortho (et ne marche pas sans). Trois équivalents en organomagnésien sont nécessaires pour la mener à bien.
Cette méthode est devenu l'une des voies de synthèse les plus rapides et les plus polyvalentes des indoles 7-substitutés[5],[6]. La synthèse de Leimgruber-Batcho de l'indole donne des résultats similaires, tant en temer de flexibilité et que des régiospécificité des dérivés indolés. Cependant, la synthèse de Bartoli a l'aventage de produire des indoles substitués à la fois sur le cycle benzénique, et sur le cycle de pyrrole ring, ce qui est difficile avec la synthèse de Leimgruber-Batchos.
Sommaire
Mécanisme réactionnel
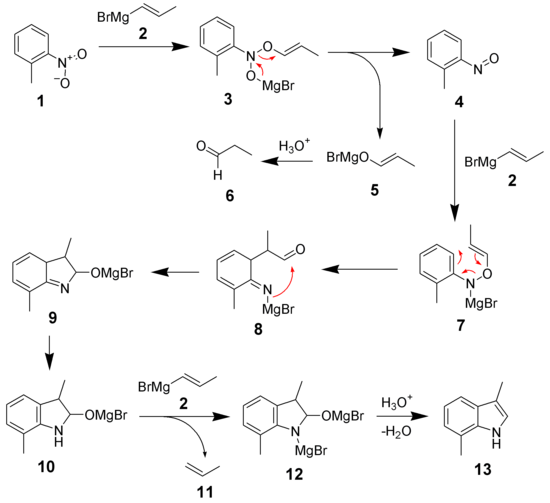
Le mécanisme réactionnel[7] de la synthèse de Bartoli de l'indole est illustrée ci-dessous, à partir d'o-nitrotoluène (1) et d'organomagnésien propényle (2) pour former le 3,7-diméthylindole (13).
Le mécanisme débute par une addition de l'organomagnésien (2) sur le nitrotoluène (1) pour former l'intermédiaire 3. Celui-ci se décompose spontanément pour former le nitrosotoluène (4) et un sel de magnésium (5) (pendant le reste de la réaction, le sel de magnésium va libérer un composé carbonylé, 6). La réaction du nitrosotoluène (4) avec un second équivalent d'organomagnésien (2) forme l'intermédiaire 7. L'encombrement stérique du groupe en ortho (ici le groupe méthyle) provoque un réarrangement [3,3]-sigmatropique formant l'intermédiaire 8. Une cyclisation et une tautomérisation donne l'intermédiaire 10, qui réagit avec un troisième équivalent d'organomagnésien (2) pour donner un sel indolé de dimagnésium (12). Une déshydratation donne l'indole désiré (13).
Trois équivalents d'organomagnésien sont donc nécessaires :
- l'un est transformé en composé carbonylé (6),
- l'un est protoné en alcène (11),
- le dernier est incorporé au composé indolé.
Variantes
Modification de Dobbs
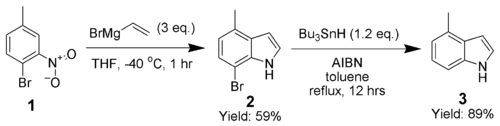
Adrian Dobbs a grandement amélioré le champs des possibilités de la synthèse de Bartoli en utilisant un dérivé ortho-bromé comme groupe directeur, qu'on peut retirer avec de l'AIBN et de l'hydrure de tributylétain[8].
Cette modification permet donc de synthétiser des réactifs initiaux non ortho-substitués, et permet par exemple la synthèse du 4-méthylindole (3), ce qui prouve la capaccité de cette méthode à produite des indoles multi-subsitutés.
Notes et références
- Bartoli, G, « The reaction of vinyl grignard reagents with 2-substituted nitroarenes: A new approach to the synthesis of 7-substituted indoles », dans Tetrahedron Lett., vol. 30, 1989, p. 2129–2132 [lien DOI])
- G. Bartoli, « Reactivity of nitro- and nitroso-arenes with vinyl grignard reagents: synthesis of 2-(trimethylsilyl)indoles », dans J. Chem. Soc., Perkin Trans. 1, vol. 1, 1991, p. 2757–2761 [lien DOI]
- A. P. Dobbs, « Synthesis of Novel Indole Derivatives: Variations in the Bartoli Reaction », dans Synlett, vol. 1999, 1999, p. 1594–1596 [lien DOI]
- R. Dalpozzo, « Bartoli Indole Synthesis », dans Curr. Org. Chem, vol. 9, 2005, p. 163–178 [texte intégral, lien DOI]
- D. Dobson, « The Synthesis of 7-Alkoxyindoles », dans Synth. Commun, vol. 21, 1991, p. 611–617 [lien DOI]
- D. R. Dobson, « Synthesis of 7-Formylindole Using the Bartoli Indole Methodology », dans Synlett, vol. 1992, 1992, p. 79–80 [lien DOI]
- Bosco, M.; Dalpozzo, R.; Bartoli, G.; Palmieri, G.; Petrini, M. J. Chem. Soc. Perkin Trans. 2 1991, 657-663.
- Dobbs, A, « Total Synthesis of Indoles from Tricholoma Species via Bartoli/Heteroaryl Radical Methodologies », dans J. Org. Chem., vol. 66, 2001, p. 638–641 [lien DOI]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Bartoli indole synthesis » (voir la liste des auteurs)
Voir aussi
Catégorie :- Réaction formant un indole
Wikimedia Foundation. 2010.