- Synthèse de Leimgruber-Batcho de l'indole
-
La synthèse de Leimgruber-Batcho de l'indole est une série de réactions organiques permettant de produire de l'indole à partir de 2-nitrotoluène (orthonitrotoluène)[1],[2],[3]. Découverte et brevetée en 1976, cette méthode permet de préparer de l'indole et des dérivés substitués avec un bon rendement dans des conditions de synthèse « douces ». Elle est tout particulièrement utilisée dans l'industrie pharmaceutique pour préparer des médicaments dont la structure contient des dérivés indolés.
Cette synthèse a été très utilisée dans l'industrie bien avant que la méthode soit publiée dans la littérature scientifique. La bonne maîtrise d'une méthode de synthèse de l'indole est en effet importante pour l'industrie pharmaceutique, de nombreux dérivés de l'indole étant utilisés comme principe actif dans des médicaments. Cette méthode est devenue une alternative très populaire à la méthode de Fischer, car de nombreux dérivés de l'ortho-nitrotoluène sont disponibles commercialement ou aisés à préparer.
Sommaire
Mécanisme réactionnel
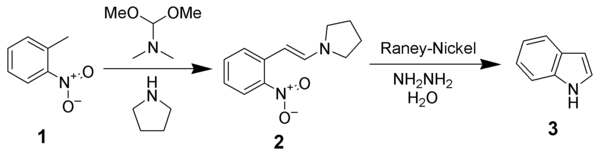
Cette synthèse s'effectue en deux étapes, à partir de l'ortho-nitrotoluène (1). la première étape est la transformation de celui-ci en énamine, en utilisant le diméthylformamide diméthylacétal et la pyrrolidine[4].
La pyrrolidine réagit avec le diméthylformamide diméthylacétal en éliminant de la diméthylamine (DMA, gaz), ce qui permet de la rendre plus réactive. Le groupement méthyle du nitrotoluène peut être déprotoné, et le carbanion qui en résulte peut attaquer la pyrrolidine activée, ce qui conduit à l'énamine (2) avec une élimination simultanée de méthanol Cette réaction peut également être mise en œuvre sans pyrrolidine en utilisant de la N,N-diméthylenamine, mais la réaction peut alors être nettement plus lente dans certains cas.
La seconde étape est une réaction d'hydrogénation/réduction qui permet la cyclisation. Le groupement nitro -NO2- est réduit groupement amine -NH2 par hydrogénation, utilisant comme source en hydrogène l'hydrazine (hydrogénation par transfert), décomposée spontanément en présence de nickel, et catalysée par le nickel de Raney. Cette réaction est suivie par une élimination de la pyrrolidine conduisant à l'indole.
L'étape d'hydrogénation réductive utilise du nickel de Raney et de l'hydrazine, mais on peut d'autres d'autres sources en hydrogène et d'autres catalyseurs, comme du palladium sur carbone et du dihydrogène, du chlorure d'étain(II), du dithionite de sodium[5], ou du fer dans l'acide acétique[6].
Divers
Les énamines intermédiaires sont liés électroniquement aux « oléfines push-pull », ayant un groupe nitro électro-attracteur conjugué à un groupe électro-donneur. Cette conjugaison étendue signifie que ces composés sont souvent d'une couleur rouge intense.
Variantes
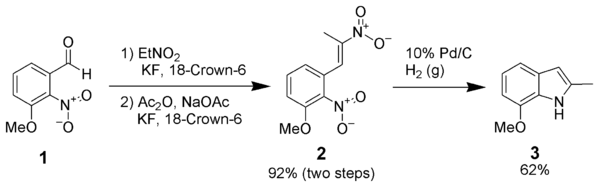
Cyclisation réductive du dinitrostyrène
La cyclisation réductive du dinitrostyrène (2) est une autre méthode a prouvé son efficacité quand d'autres méthodes plus communes échouaient[7]. Elle part d'un dérivé de l'orthonitrobenzaldéhyde (ici le 3-méthoxy-2-nitrobenzaldéhyde), dont la fonction aldéhyde est transformé en deux étapes en 2-nitroéthylène, formant un dérivé du dinitrostyrène. Ce dernier est hydrogéné/réduit (dans cet exemple par le dihydrogène catalysé par le palladium sur carbone), et ce cyclise en dérivé indolé.
La plupart des méthodes d'hydrogénation standards listé ci-dessus fonctionne pour cette réaction.
Notes et références
- Batcho, A. D.; Leimgruber, W. (en) Brevet U.S. 3732245 & (en) Brevet U.S. 3976639
- Batcho, A. D.; Leimgruber, W. Org. Synth. 1985, 63, 214-220. (Article).
- Clark, R. D.; Repke, D. B. Heterocycles 1984, 22, 195-221. (Review)
- Maehr, H.; Smallheer, J. M. J. Org. Chem. 1981, 46, 1753. (DOI:10.1021/jo00321a053).
- Garcia, E. E.; Fryer, R. I. J. Heterocycl. Chem. 1974, 11, 219.
- Ponticello, G. S.; Baldwin, J. J. J. Org. Chem. 1979, 44, 4003. (DOI:10.1021/jo01336a065)
- Chen, B.-C.; Hynes, Jr., J.; Randit, C. R.; Zhao, R.; Skoumbourdis, A. P.; Wu, H.; Sundeen, J. E.; Leftheris, K. Heterocycles 2001, 55, 951.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Leimgruber-Batcho indole synthesis » (voir la liste des auteurs)
Voir aussi
Catégorie :- Réaction formant un indole
Wikimedia Foundation. 2010.