- Réarrangement de Claisen
-
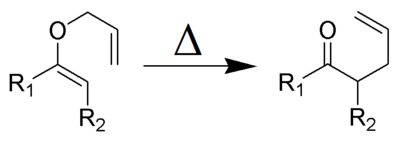
Le réarrangement de Claisen (à ne pas confondre avec la condensation du même nom) est une réaction chimique formant une liaison carbone carbone, découverte par Rainer Ludwig Claisen. Lorsqu'on chauffe un vinyl éther allylique, une transposition sigmatropique-[3,3] a lieu et donne un composé carbonylé γ,δ insaturé.
Découvert en 1912, le réarrangement de Claisen est le premier exemple relevé de réarrangement sigmatropique-[3,3][1],[2],[3] . De nombreuses études ont été publiées sur le sujet[4],[5],[6],[7] .
Sommaire
Mécanisme
Le réarrangement de Claisen (et ses variantes) sont exothermiques (~84 kJ/mol), il s'agit de réactions péricycliques concertées avec approche suprafaciale selon les règles de Woodward-Hoffmann. Les effets de solvant joue un rôle important dans ces réactions. Un solvant plus polaire tend à accélérer la réaction. Ceux permettant de créer des liaisons hydrogènes permettent d'obtenir les constantes de vitesses les plus grandes. Par exemple un mélange éthanol/eau donne une constante de vitesse dix fois plus grande que pour le sulfolane.
Il a été montré que les réactifs organoaluminium comme le triméthylaluminium accélèrent cette réaction[8],[9].
Variantes
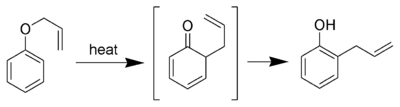
Réarrangement aromatique de Claisen
La variante aromatique du réarrangement de claisen est le réarrangement [3,3]-sigmatropique d'un phényl éther allylique en un intermédiaire qui tautomérise rapidement pour donner un phénol substitué en ortho.
Si la position ortho est substituée, il y a déplacement vers la position para avec rétention de configuration.
Réarrangement de Bellus-Claisen
Le réarrangement de Bellus-Claisen consiste en la réaction d'éther allyliques, amines ou thioéthers sur des cétènes pour former des esters, amides, thioesters γ,δ-insaturés[10],[11],[12].

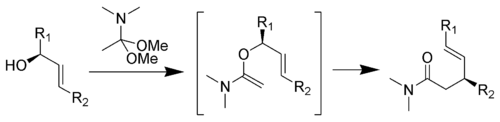
Réarrangement de Eschenmoser-Claisen
Le réarrangement de Eschenmoser-Claisen convertit un alcool allylique en un amide γ,δ-insaturée et a été mis au point par Albert Eschenmoser en 1964[13],[14].
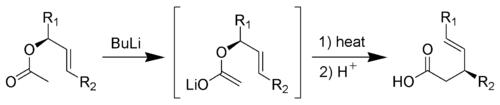
Réarrangement de Ireland-Claisen
C'est la réaction d'un acétate allylique avec une base forte (comme), elle forme un acide carboxylique γ,δ-insaturé[15],[16],[17].
Réarrangement de Johnson-Claisen
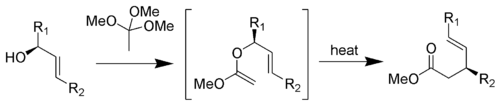
Ce réarrangement consiste en la réaction d'un alcool allylique avec le orthoacétate de méthyle pour former un ester γ,δ-insaturé[18].
Réactions dérivées de Claisen
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Claisen rearrangement » (voir la liste des auteurs)
- Claisen, L.; Ber. 1912, 45, 3157.
- Claisen, L.; Tietze, E.; Ber. 1925, 58, 275.
- Claisen, L.; Tietze, E.; Ber. 1926, 59, 2344.
- Hiersemann, M.; Nubbemeyer, U. (2007) The Claisen Rearrangement. Wiley-VCH. ISBN 3527308253
- Rhoads, S. J.; Raulins, N. R.; Org. React. 1975, 22, 1-252. (Review)
- Ziegler, F. E.; Chem. Rev. 1988, 88, 1423-1452. (Review)
- Wipf, P.; Comp. Org. Syn. 1991, 5, 827-873.
- Goering, H. L.; Jacobson, R. R.; J. Am. Chem. Soc. 1958, 80, 3277.
- White, W. N.; Wolfarth, E. F.; J. Org. Chem. 1970, 35, 2196.
- Malherbe, R.; Bellus, D.; Helv. Chim. Acta 1978, 61, 3096-3099.
- Malherbe, R.; Rist, G.; Bellus, D.; J. Org. Chem. 1983, 48, 860-869.
- Gonda, J.; Angew. Chem. Int. Ed. 2004, 43, 3516-3524.
- Wick, A. E.; Felix, D.; Steen, K.; Eschenmoser, A.; Helv. Chim. Acta 1964, 47, 2425-2429.
- Wick, A. E.; Felix, D.; Gschwend-Steen, K.; Eschenmoser, A.; Helv. Chim. Acta 1969, 52, 1030-1042.
- Ireland, R. E.; Mueller, R. H. (1972). "Claisen rearrangement of allyl esters". Journal of the American Chemical Society 94: 5897. doi:10.1021/ja00771a062}
- Ireland, R. E.; Willard, A. K.; Tetrahedron Lett. 1975, 16, 3975-3978.
- Ireland, R. E.; Mueller, R. H.; Willard, A. K. (1976). "The ester enolate Claisen rearrangement. Stereochemical control through stereoselective enolate formation". Journal of the American Chemical Society 98: 2868. doi:10.1021/ja00426a033
- Johnson, W. S. et al.; J. Am. Chem. Soc. 1970, 92, 741.
Lien externe
Wikimedia Foundation. 2010.