- Réarrangement de Brook
-
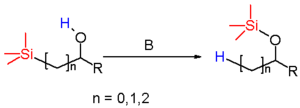
En chimie organique, le réarrangement de Brook est une réaction de réarrangement dans laquelle un groupe organosilyle lié de façon covalente à un atome de carbone change de position avec le proton d'un groupe hydroxyle sous l'effet d'une base. Il doit son nom au chimiste canadien Adrian Gibbs Brook (1924-). Le produit de la réaction est un éther de silyle.
Les substituants du silyle peuvent être aliphatiques (méthyle) ou aromatiques (phényle) et l'alcool peut être secondaire ou tertiaire avec des groupements aliphatiques ou aryles. La base est une amine, l'hydroxyde de sodium, un organolithien ou un alliage de métaux alcalins tels que Na/K. Quand le réactif est un silylméthanol, la réaction prend le nom de réarrangement de Brook 1,2 mais des réarrangements sur de plus grands squelettes carbonés sont aussi possibles.
Mécanisme de la réaction
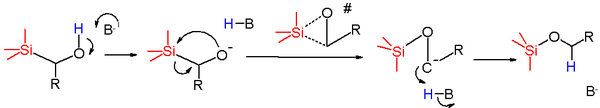
Le mécanisme réactionnel de ce réarrangement commence par la déprotonation du groupe hydroxyle par la base pour former l'alcoolate. Ce nucléophile attaque alors l'atome de silicium dans une réaction de substitution nucléophile avec le groupe méthylène comme groupe partant. L'état de transition supposé est cyclique la formation de la liaison Si-O et la rupture de la liaison Si-C ayant lieu simultanément. La paire d'électrons restante est ensuite transférée de l'oxygène au carbone pour former un carbanion qui soustrait rapidement un proton à une source de protons telle que le solvant pour donner l'éther de silyle.
Quand le réactif est le (triphénylsilyl)méthylphénylméthanol, l'énergie d'activation est relativement basse mais l'entropie d'activation est largement négative, ce qui va dans le sens d'un état de transition cyclique. Les résultats de Hammett pour un groupe de phénylméthanols para-substitués confirment que les groupements accepteurs d'électrons aident à stabiliser la charge négative formé dans l'intermédiaire carbanionique.
La force motrice thermodynamique de cette réaction est la formation de la liaison silicium oxygène. Les ruptures des liaisons Si-C et O-H ont un coût énergétique en termes d'énergie de dissociation de 451 + 427 = 878 kJ/mol et les gains énergétiques s'élèvent à 809 (Si-O) + 338 (C-H) = 1147 kJ/mol.
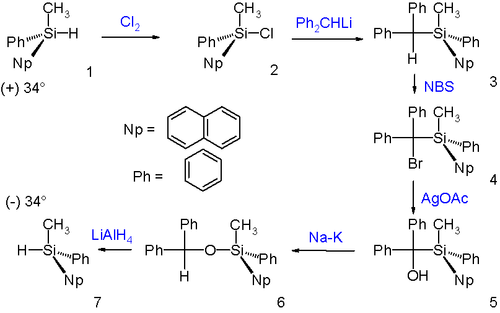
Le réarrangement de Brook a lieu avec inversion de configuration comme démontré par un cycle de Walden :
L'énantiomère (+) du silane réagit avec le chlore pour donner le cholorosilane correspondant, avec rétention de configuration. La réaction suivante de substitution nucléophile du chlore par le diphénylméthyllithium s'effectue avec inversion de configuration. Les deux étapes suivantes convertissent le groupement diphénylméthine en diphénylméthanol sans changement de configuration par bromination par NBS suivie de l'hydrolyse par l'acétate d'argent. Le réarrangement de Brook qui s'ensuit et la réduction par l'hydrure d'aluminium et de lithium s'effectuent avec rétention de configuration. Le produit final de la réaction est donc l'énantiomère opposé à celui du produit de départ et son pouvoir rotatoire est donc de signe opposé.
Application
Des réarrangements de Brook se produisent avec les acylsilanes [1] et avec certains éthers de silyle spécifiques des réarrangements retro-brook sont aussi possibles[2]. Un réarrangement phospha-Brook analogue des 1-hydroxyphosphonates a aussi été décrit.
References
- Patrocinio, Amauri F. and Moran, Paulo J. S. Acylsilanes and their applications in organic chemistry. J. Braz. Chem. Soc., 2001, vol.12, no.1, p.07-31. ISSN 0103-5053. Online article
- Stereochemistry of the cyclization of 4-(t-butyldimethyl)siloxy-5-hexenyllithium: cis-selective ring-closure accompanied by retro-[1,4]-Brook rearrangement William F. Bailey and Xinglong Jiang Arkivoc 2005 (vi) 25-32 Online article
Wikimedia Foundation. 2010.