- Protéines urinaires majeures
-
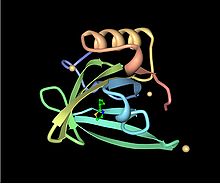
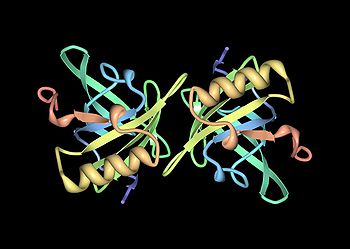
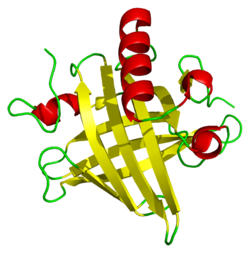 Structure tertiaire d'une protéine urinaire majeure de souris. Cette protéine a huit feuillets béta (en jaune) et des hélices alpha (en rouge).
Structure tertiaire d'une protéine urinaire majeure de souris. Cette protéine a huit feuillets béta (en jaune) et des hélices alpha (en rouge).
Les protéines urinaires majeures (Major urinary proteins MUPs en anglais), également connues sous le nom d’α2u-globulines sont une sous-famille de protéines que l'on trouve en abondance dans l'urine et d'autres sécrétions de nombreux animaux. Elles fournissent quelques informations permettant l'identification de l'animal producteur, après avoir été repérées par l'organe voméro-nasal de l'animal récepteur. Elles appartiennent à une grande famille de protéines appelées lipocalines. Elles sont codées par un groupe de gènes, situés côte à côte sur un seul tronçon d'ADN, qui varie grandement selon les espèces: d'au moins 21 gènes fonctionnels chez la souris à aucun chez l'homme. Ces protéines ont une forme caractéristique de gant, comprenant une poche de liaison du ligand spécifique qui accueille de petits produits chimiques organiques spécifiques.
Les protéines urinaires ont été découvertes chez l'homme en 1932, au cours d'études par Thomas Addis sur les causes de protéinuries. Les MUPs sont de puissants allergènes chez l'homme et sont lrs principales responsables d'un certain nombre d'allergies aux animaux comme les chats, les chevaux et les rongeurs. Leur fonction endogène est inconnue, mais elles pourraient intervenir dans la régulation des dépenses énergétiques. Toutefois, ces protéines jouent de multiples rôles dans la communication chimique entre animaux, servant de transporteurs et de stabilisateurs de phéromones chez les rongeurs et les porcs. Elles peuvent aussi agir comme des phéromones protéiques. On a démontré qu'elles provoquaient un comportement agressif chez les souris mâles et qu'une protéine spécifique retrouvée dans l'urine de souris mâle était sexuellement attirante pour les femelles. Elles peuvent également fonctionner comme des signaux entre des espèces différentes: des souris affichent une réaction de peur instinctive à la détection de MUPs provenant de prédateurs comme les chats et les rats.
Sommaire
Découvertes
Les êtres humains en bonne santé n'excrètent dans leurs urines que de très faibles quantités de protéines. C'est pourquoi, depuis 1827, médecins et scientifiques se sont intéressés à la présence anormale de protéines dans les urines (protéinurie) comme indicateur de maladie rénale[2],[3]. Pour mieux comprendre l'origine de la protéinurie, certains scientifiques ont tenté d'étudier le phénomène sur des animaux de laboratoire[4]. Entre 1932 et 1933, un certain nombre de scientifiques, dont Thomas Addis, ont découvert indépendamment les uns des autres que certains rongeurs sains ont des protéines dans leurs urines[5],[6],[7]. Toutefois, il a fallu attendre les années 1960 pour que les principales protéines urinaires de souris et de rats soient décrites en détail[8],[9]. On a constaté que ces protéines sont principalement produites dans le foie des mâles et sécrétées par les reins en quantités chiffrées en milligrammes par jour[8],[9],[10].
Depuis qu'elles ont été découvertes, ces protéines ont été retrouvées exprimées de façon différente dans des glandes exocrines comme notamment les glandes lacrymales, parotides, submaxillaires, sublinguales, préputiales et mammaires[11],[12],[13]. Chez certaines espèces, comme les chats et les porcs, les MUPs ne sont pas trouvées dans les urines mais dans les sécrétions, principalement dans la salive[14],[15]. Parfois, le terme de MUPs urinaires (uMUPs) est utilisé pour distinguer les MUPs retrouvées dans l'urine de celles trouvées dans d'autres tissus[16].
Les gènes MUPs
Entre 1979 et 1981, on a découvert que les MUPs sont codées par une famille de gènes comprenant entre 15 et 35 gènes et pseudogènes chez la souris et par environ 20 gènes chez le rat[17],[18],[19]. En 2008, un nombre plus exact de gènes MUP de toute une série d'espèces ont été découverts en analysant les séquences d'ADN de génomes entiers[1],[20].
Rongeurs
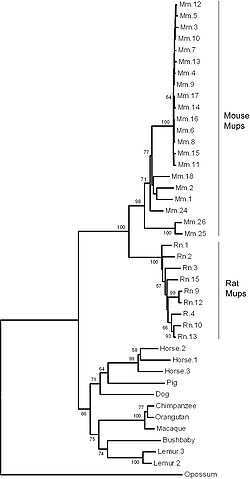
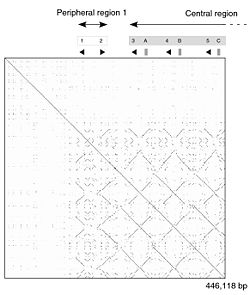
Le génome de référence est celui de la souris qui a au moins 21 gènes distincts MUPs (avec des cadres ouverts de lecture) et 21 autres pseudogènes MUPs (avec des cadres de lecture perturbés par une mutation non-sens ou une duplication incomplète de gènes. Ils sont tous regroupés, situés côte à côte dans 1,92 mégabases d'ADN sur le chromosome 4. Les 21 gènes fonctionnels ont été divisés en deux sous-classes en fonction de leur position et de la similarité des séquences: 6 périphériques de « Classe A Mups » et 15 centraux de « catégorie B Mups »[1],[21]. Le groupe de gènes de la classe B est formé par un certain nombre de duplications de l'un des gènes de catégorie A. Comme tous les gènes de classe B sont presque identiques les uns aux autres, les chercheurs en ont conclu que ces duplications ont eu lieu très récemment dans l'évolution de la souris. En effet, la structure répétitive de ces gènes MUPs centraux signifie qu'ils sont susceptibles d'être instables et peuvent varier en nombre chez les souris dans la nature[21]. Les gènes de classe A sont plus différents entre eux et sont donc susceptibles d'être plus stables mais si elles existent, les différences fonctionnelles de ces classes sont inconnues[1]. La similitude entre les gènes de la région rend difficile l'étude de l'ADN en utilisant la technologie actuelle de séquençage. En conséquence, le groupe de gènes MUPs est l'un des rares parties du génome de la souris présentant encore des lacunes et où d'autres gènes peuvent être encore ignorés[1],[21].
L'urine du rat contient également des protéines urinaires homologues; bien qu'elles aient reçu au départ un nom différent -les α2u-globulines[9],[10]-, elles sont maintenant connues comme les rat MUPs[22],[23]. Les rats ont 9 gènes MUPS distincts et 13 autres pseudogènes regroupés dans 1,1 mégabase d'ADN sur le chromosome 5. Comme chez la souris, le groupe est formé de nombreuses duplications. Toutefois, cela s'est produit de façon indépendante des duplications chez la souris, ce qui signifie que ces deux genres de rongeurs ont élargi leur familles de gènes MUPs séparément, mais en parallèle[1],[24].
Non-rongeurs
La plupart des autres mammifères étudiés, y compris le porc, la vache, le chat, le chien, le galago, le macaque, le chimpanzé et l'orang-outan, ont un seul gène MUP. Certains, toutefois, en ont un plus grand nombre: le cheval a trois gènes MUP et le Microcèbe mignon en a au moins deux. Insectes, poissons, amphibiens, oiseaux et marsupiaux semblent avoir une synténie perturbée au niveau de la position du groupe de gènes MUPs, suggérant que cette famille de gènes est peut être spécifique aux mammifères placentaires[1]. L'homme est le seuls mammifère placentaire n'ayant pas de gène MUP actif, mais plutôt qui a un pseudogène unique contenant une mutation qui provoque un mauvas épissage, le rendant non fonctionnel[1].
Rôles=====Protéines de transport=
Les MUPs appartiennent à une grande famille de protéines de bas poids moléculaire (~ 19 kDa) appelées lipocalines[26]. Elles ont une structure caractéristique faite de huit feuillets beta antiparallèles formant une sorte de tonneau ouvert, avec des hélices alpha aux deux extrémités[26]. Elles ont par conséquent, une forme caractéristique de gant, comprenant une poche qui peut fixer de petits produits chimiques organiques ayant une haute affinité[1],[27]. Un certain nombre de ligands se fixent ainsi aux MUPs de souris, comme le 2-sec-butyl-4,5-dihydrothiazole (en abrégé SBT ou DHT), le 6-hydroxy-6-méthyl-3-heptanone (HMH) et la 2,3 dihydro-exo-brévicomine (DHB)[28],[29],[30]. Ce sont tous des produits chimiques spécifiques de l'urine qui se sont montrés être des phéromones c'est-à-dire des produits excrétés par un individu et qui déclenchent une réaction innée de comportement d'un autre membre de la même espèce[28],[31]. On a également démontré que les MUPs de souris servaient de stabilisateurs de phéromone, permettant une libération lente du produit qui prolonge la durée de vie des phéromones urinaires volatiles utilisées par les mâles pour marquer leurs territoires[32]. Compte tenu de la diversité des MUPs chez les rongeurs, on a d'abord pensé que les différents MUPs avaient des poches de formes différentes et fixaient donc des phéromones différentes. Toutefois, des études détaillées ont permis de constater que la plupart des sites variables sont situés à la surface des protéines et semblent avoir peu d'effet sur la liaison du ligand[33].
Les MUPs de rats fixent différents produits chimiques de petite taille. Le 1-chlorodécane est le ligand le plus commun, alors que le 2-méthyl-N-phényl-2-amide hexadécane et le 2,6,11-triméthyl décane semblent un peu moins communs[34]. Les MUPs de certaines espèces de rats fixent également le limonène-1,2-époxyde, ce qui entraîne une maladie du rein chez l'hôte, la néphropathie à gouttelettes hyalines qui évolue en cancer. D'autres espèces ne développent pas cette maladie parce que leur MUPs ne se lient pas à ce produit chimique[35]. Lorsque des souris transgéniques ont été génétiquement modifiées pour exprimer ce MUP de rat, leurs reins développent la maladie[36]. Cette MUP, retrouvée chez les porcs, nommée lipocaline salivaire (SAL), est produite par les glandes salivaires des mâles et se lie étroitement à l'androsténone et à l'androsténol, deux phéromones qui provoquent chez les femelles une position d'accouplement[1],[15].
Les phéromones
On a mené des études pour connaître le rôle précis des Mups dans les communications par phéromones. On a montré que ces protéines provoquaient l'apparition de la puberté et accéléraient l'œstrus chez les souris femelles, induisant les effets Vandenbergh et Whitten[37],[38]. Toutefois, dans les deux cas, les MUPs devaient être présentées aux femelles dissoutes dans l'urine des mâles, indiquant que la protéine nécessite un certain complément urinaire pour fonctionner. En 2007, des MUPs que l'on trouve normalement dans l'urine de souris mâles ont été synthétisées par des bactéries transgéniques. Elles étaient donc dépourvues de leurs ligands habituels. Ces Mups se sont avérées suffisantes pour déclencher un comportement agressif chez les mâles, même en l'absence d'urine[20]. En outre, ces Mups faites par des bactéries peuvent activer les neurones sensoriels olfactifs de l'organe voméronasal (VNO), une partie du nez qui détecte les phéromones spécifiques via des récepteurs sensoriels, chez les souris et les rats[20],[39]. L'ensemble de ces faits démontre que les protéines MUPs peuvent se comporter comme des phéromones eux-mêmes, indépendamment de leurs ligands[40].
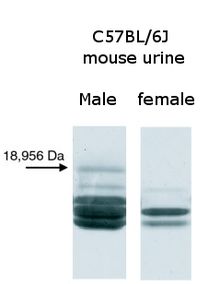
En accord avec le comportement agressif des souris mâles entre elles, on a constaté que les souris mâles adultes produisaient davantage de MUPs dans leur urine que les femelles, les jeunes ou les mâles castrés. Le mécanisme précis de l'origine de cette différence entre sexes est complexe, mais au moins trois hormones: testostérone, hormone de croissance et thyroxine sont connues pour influer positivement sur la production de MUPs chez la souris[41]. L'urine des souris communes sauvages contient des proportions variables de quatre à sept protéines MUPs distinctes par souris[42]. Certaines souches consanguines de souris de laboratoire, telles que BALB/c et C57BL/6, ont également différentes protéines dans leur urine[21]. Cependant, contrairement aux souris sauvages, les différents individus d'une même souche produisent le même modèle de protéine, un artefact dû à de nombreuses générations de consanguinité[43],[44]. Un MUP est un peu moins variable que les autres: il est toujours produit dans de fortes proportions chez les souris mâles sauvages et n'est presque jamais retrouvé dans l'urine des femelles. Lorsque ce MUP a été synthétisé par des bactéries et utilisé pour des tests de comportement, on a constaté qu'il attirait les souris femelles. D'autres MUPs ont été testés, mais ils n'ont pas les mêmes qualités attrayantes, ce qui suggère que ce MUP spécifique du sexe masculin se comporte comme une phéromone sexuelle[45]. Les scientifiques ont appelé ce MUP Darcin, référence humoristique à Fitzwilliam Darcy, le héros romantique de « Orgueil et Préjugés »[46],[47]. Dans l'ensemble, les modèles complexes de MUPs permettent théoriquement de fournir des informations à distance sur l'animal producteur, comme le sexe, la fécondité, la dominance sociale, l'âge, la diversité génétique ou la parenté[20],[48],[49]. Les souris sauvages (à la différence des souris de laboratoire qui sont génétiquement identiques et qui ont donc également des MUPs identiques) ont des modes d'expression individuelle par leurs MUPs urinaires qui agissent comme un code-barre pour identifier le propriétaire d'une odeur caractéristique[48].
Les kairomones
En plus de servir de signaux sociaux entre membres de la même espèce, les MUPs peuvent agir comme kairomones, ces substances chimiques qui transmettent des informations entre espèces[50],[51],[52]. Les souris sont instinctivement peur lorsqu'elles détectent l'odeur de leurs prédateurs naturels, comme les chats et les rats. Cela se produit même chez des souris de laboratoire qui ont été isolées des prédateurs depuis des centaines de générations[53]. Lorsque les signaux chimiques responsables de la réaction de peur ont été purifiés à partir de la salive de chat et de l'urine du rat, deux protéines homologues ont été identifiées: Fel d 4 (Felis domesticus allergène 4), produite par le gène MUP des chats, et Rat n 1 (Rattus norvegicus allergène 1), produit par le gène Mup13 du rat[51]. Les souris ont peur en sentant ces Mups même quand ils sont produits par des bactéries, alors que des animaux mutants, incapables de détecter le Mups, n'ont montré aucune peur des rats, ce qui démontre leur importance dans l'apparition du comportement de peur[50],[54]. On ne sait pas exactement comment les MUPs provenant de différentes espèces provoquent des comportements disparates, mais on a démontré que les MUPs de souris et les MUPs de prédateurs activaient les mêmes neurones sensoriels du nez des souris. Cela implique que la souris les perçoit différemment, par le biais des circuits neuronaux distincts[50],[51]. Les récepteurs de phéromones responsables de la détection des MUPs sont également inconnus, même si l'on pense qu'ils sont de la classe des récepteurs V2R[20],[51].
Allergènes
Avec d'autres membres de la famille des lipocalines, les protéines urinaires majeures peuvent être des allergènes puissants pour les humains[56]. La raison n'en est pas connue mais la ressemblance moléculaire entre les MUPs et des lipocalines humaines structurellement similaires est une explication possible[57]. La protéine produite par le gène MUP17 de la souris, connue sous le nom de Mus m 1, Ag1 ou MA1 figure parmi les plus puissants allergènes de l'urine de souris[1],[58]. Cette protéine est extrêmement stable dans l'environnement. Des études l'ont trouvé dans 95% des foyers urbains et 82% de tous les types de logements aux États-Unis en ont un niveau détectable dans au moins une pièce[59],[60]. De même, Rat n 1 est un allergène connu pour l'homme[56]. Une étude américaine a constaté sa présence dans 33% des logements urbains et 21% de leurs occupants ont été sensibilisés à l'allergène[61]. L'exposition et la sensibilisation aux protéines MUPs de rongeurs est considérée comme un facteur de risque pour l'asthme infantile et une cause majeure d'allergie aux animaux de laboratoire (AAL)-une maladie professionnelle des techniciens et des scientifiques travaillant sur ce type d'animaux[62],[63],[64],[65]. Une étude a révélé que les deux tiers des travailleurs de laboratoire qui ont développé des réactions asthmatiques à des animaux présentaient des anticorps contre le MUP Rat n 1[66].
Les gènes MUPs d'autres mammifères codent aussi pour des protéines allergisantes, par exemple Fel d 4 est une protéine produite principalement par les glandes salivaires sous-maxillaires et que le chat dépose sur ses poils lorsqu'il fait sa toilette. Une étude a montré que 63% des personnes allergiques aux chats ont des anticorps contre cette protéine. La plupart avaient des titres d'anticorps anti-Fel d 4 supérieurs à ceux anti-Fel d 1, un autre allergène des plus connus du chat[14]. De même, Equ c1 (Equus caballus allergène 1) est une protéine MUP de cheval produite par le foie et les glandes salivaires submaxillaires et sublinguales[1],[67]. Elle est responsable d'environ 80% des anticorps retrouvés chez les patients exposés de façon chronique aux allergènes de cheval[67].
Métabolisme
Bien qu'on ait étudié des Mups excrétés par d'autres animaux, on connait peu de choses sur leur rôle fonctionnel. Toutefois, en 2009, on a montré que les Mups se sont avérés être associés à la régulation de la dépense énergétique chez la souris. Les scientifiques ont découvert que des souris génétiquement induites obèses et diabétiques produisaient trente fois moins d'ARN de MUPs que leurs congénères de poids normal[68]. Quand on injecte directement des protéines Mup dans le sang de ces souris, on observe une augmentation de leur dépense énergétique, de leur activité physique et de leur température corporelle ainsi qu'une diminution correspondante de leur [[intolérance au glucose] (f;] et de leur résistance à l'insuline. Il semble que les effets bénéfiques des Mups sur le métabolisme énergétique soient dus à l'amélioration de la fonction mitochondriale dans les muscles du squelette[68]. Une étude a montré que les Mups diminuaient chez les souris rendues obèses par l'alimentation. Dans ce cas, la présence de Mups dans la circulation sanguine des souris diminuait la production de glucose en inhibant directement l'expression des gènes dans le foie[69].
Voir aussi
- Acétate de vaccenyl, une phéromone de drosophile
- Complexe majeur d'histocompatibilité
- Protéines produites et sécrétées par le foie
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Major urinary proteins » (voir la liste des auteurs)
- DW LoganW, TF Marton, L Stowers, « Species specificity in major urinary proteins by parallel evolution », dans PLoS ONE, vol. 3, no 9, 2008, p. e3280 [lien PMID, lien DOI]
- C'est cette même année que Richard Bright décrivit pour la première fois une maladie connue sous le nom de maladie de Bright ou insuffisance rénale chronique avec présence d'albumine dans l'urine.
- WD Comper, LM Hilliard, DJ Nikolic-Paterson, LM Russo, « Disease-dependent mechanisms of albuminuria », dans Am. J. Physiol. Renal Physiol., vol. 295, no 6, décembre 2008, p. F1589–600 [lien PMID, lien DOI]
- KV Lemley, L. Pauling, « Thomas Addis: 1881–1949 », dans Biographical Memoirs, National Academy of Sciences, vol. 63, 1994, p. 1–46 [texte intégral]
- T. Addis, « Proteinuria and cylinduria », dans Proceedings of the California Academy of Sciences, vol. 2, 1932, p. 38–52
- Bell ME., « Albuminuria in the normal male rat », dans Journal of Physiology, vol. 79, no 2, septembre 1933, p. 191–93 [lien PMID]
- IA Parfentjev, WA Perlzweig, « The Composition of the Urine of White Mice », dans The Journal of Biological Chemistry, vol. 100, 1933, p. 551–55 [texte intégral]
- JS Finlayson, R Asofsky, M Potter, CC Runner, « Major urinary protein complex of normal mice: origin », dans Science, vol. 149, no 687, août 1965, p. 981–82 [lien PMID, lien DOI]
- AK Roy, OW Neuhaus, « Identification of rat urinary proteins by zone and immunoelectrophoresis », dans Proceedings of the Society for Experimental Biology and Medicine, vol. 121, no 3, mars 1966, p. 894–99 [lien PMID]
- AK Roy, OW Neuhaus, « Proof of the hepatic synthesis of a sex-dependent protein in the rat », dans Biochimica et Biophysica Acta, vol. 127, no 1, septembre 1966, p. 82–87 [lien PMID, lien DOI]
- WA Held, JF Gallagher, « Rat alpha 2u-globulin mRNA expression in the preputial gland », dans Biochemical Genetics, vol. 23, no 3–4, avril 1985, p. 281–90 [lien PMID, lien DOI]
- RM Gubits, KR Lynch, AB Kulkarni, et al., « Differential regulation of alpha 2u globulin gene expression in liver, lachrymal gland, and salivary gland », dans The Journal of Biological Chemistry, vol. 259, no 20, octobre 1984, p. 12803–809 [texte intégral, lien PMID]
- K Shahan, M Denaro, M Gilmartin, Y Shi, E Derman, « Expression of six mouse major urinary protein genes in the mammary, parotid, sublingual, submaxillary, and lachrymal glands and in the liver », dans Molecular and Cellular Biology, vol. 7, no 5, mai 1987, p. 1947–54 [texte intégral, lien PMID]
- Smith W, Butler AJ, Hazell LA, et al., « Fel d 4, a cat lipocalin allergen », dans Clinical and Experimental Allergy, vol. 34, no 11, novembre 2004, p. 1732–38 [lien PMID, lien DOI]
- D Loebel, A Scaloni, S Paolini, et al., « Cloning, post-translational modifications, heterologous expression and ligand-binding of boar salivary lipocalin », dans The Biochemical Journal, vol. 350, no Pt 2, septembre 2000, p. 369–79 [lien PMID, lien DOI]
- RJ Beynon, JL Hurst, « Multiple roles of major urinary proteins in the house mouse, Mus domesticus », dans Biochemical Society Transactions, vol. 31, no Pt 1, février 2003, p. 142–46 [lien PMID, lien DOI]
- DT Kurtz, « Rat alpha 2u globulin is encoded by a multigene family », dans Journal of Molecular and Applied Genetics, vol. 1, no 1, 1981, p. 29–38 [lien PMID]
- ND Hastie, WA Held, JJ Toole, « Multiple genes coding for the androgen-regulated major urinary proteins of the mouse », dans Cell, vol. 17, no 2, juin 1979, p. 449–57 [lien PMID, lien DOI]
- JO Bishop, AJ Clark, PM Clissold, S Hainey, U Francke, « Two main groups of mouse major urinary protein genes, both largely located on chromosome 4 », dans The EMBO Journal, vol. 1, no 5, 1982, p. 615–20 [lien PMID]
- P Chamero, TF Marton, DW Logan, et al., « Identification of protein pheromones that promote aggressive behaviour », dans Nature, vol. 450, no 7171, décembre 2007, p. 899–902 [lien PMID, lien DOI]
- JM Mudge, SD Armstrong, K McLaren, et al., « Dynamic instability of the major urinary protein gene family revealed by genomic and phenotypic comparisons between C57 and 129 strain mice », dans Genome Biology, vol. 9, no 5, 2008, p. R91 [lien PMID, lien DOI]
- (en) J Hurst, RJ Beynon, SC Roberts, TD Wyatt, Urinary Lipocalins in Rodenta:is there a Generic Model? , Springer New York, octobre 2007 (ISBN 978-0-387-73944-1)
- Cavaggioni A, Mucignat-Caretta C, « Major urinary proteins, alpha(2U)-globulins and aphrodisin », dans Biochimica et Biophysica Acta, vol. 1482, no 1–2, octobre 2000, p. 218–28 [lien PMID, lien DOI]
- DA McFadyen, W Addison, J Locke, « Genomic organization of the rat alpha 2u-globulin gene cluster », dans Mammalian Genome, vol. 10, no 5, mai 1999, p. 463–70 [lien PMID, lien DOI]
- Erreur dans la syntaxe du modèle ArticleZ Böcskei, CR Groom, DR Flower, et al., « Pheromone binding to two rodent urinary proteins revealed by X-ray crystallography », dans Nature, vol. 360, no 6400, p. 186–88 [lien PMID, lien DOI]
- DR Flower, « The lipocalin protein family: structure and function », dans The Biochemical Journal, vol. 318, no 1, août 1996, p. 1–14 [texte intégral, lien PMID]
- MD Ganfornina, G Gutiérrez, M Bastiani, D Sánchez, « A phylogenetic analysis of the lipocalin protein family », dans Molecular Biology and Evolution, vol. 17, no 1, janvier 2000, p. 114–26 [texte intégral, lien PMID]
- M Halpern, A Martínez-Marcos, « Structure and function of the vomeronasal system: an update », dans Progress in Neurobiology, vol. 70, no 3, juin 2003, p. 245–318 [lien PMID, lien DOI]
- DE Timm, LJ Baker, H Mueller, L Zidek, MV Novotny, « Structural basis of pheromone binding to mouse major urinary protein (MUP-I) », dans Protein Science, vol. 10, no 5, mai 2001, p. 997–1004 [lien PMID, lien DOI]
- SD Armstrong, DH Robertson, SA Cheetham, JL Hurst, RJ Beynon, « Structural and functional differences in isoforms of mouse major urinary proteins: a male-specific protein that preferentially binds a male pheromone », dans The Biochemical Journal, vol. 391, no Pt 2, octobre 2005, p. 343–50 [lien PMID, lien DOI]
- L Stowers, TF Marton, « What is a pheromone? Mammalian pheromones reconsidered », dans Neuron, vol. 46, no 5, juin 2005, p. 699–702 [lien PMID, lien DOI]
- JL Hurst, DHL Robertson, U Tolladay, RJ Beynon, « Proteins in urine scent marks of male house mice extend the longevity of olfactory signals », dans Animal Behaviour, vol. 55, no 5, mai 1998, p. 1289–97 [lien PMID, lien DOI]
- A Darwish Marie, C Veggerby, DH Robertson, et al., « Effect of polymorphisms on ligand binding by mouse major urinary proteins », dans Protein Science, vol. 10, no 2, février 2001, p. 411–17 [lien PMID, lien DOI]
- R Rajkumar, R Ilayaraja, C Mucignat, A Cavaggioni, G Archunan, « Identification of alpha2u-globulin and bound volatiles in the Indian common house rat (Rattus rattus) », dans Indian Journal of Biochemistry & Biophysics, vol. 46, no 4, août 2009, p. 319–24 [lien PMID]
- LD Lehman-McKeeman, D Caudill, « Biochemical basis for mouse resistance to hyaline droplet nephropathy: lack of relevance of the alpha 2u-globulin protein superfamily in this male rat-specific syndrome », dans Toxicology and Applied Pharmacology, vol. 112, no 2, février 1992, p. 214–21 [lien PMID, lien DOI]
- LD Lehman-McKeeman, D Caudill, « d-Limonene induced hyaline droplet nephropathy in alpha 2u-globulin transgenic mice », dans Fundamental and Applied Toxicology, vol. 23, no 4, novembre 1994, p. 562–68 [lien PMID, lien DOI]
- C Mucignat-Caretta, A Caretta, A Cavaggioni, « Acceleration of puberty onset in female mice by male urinary proteins », dans J. Physiol. (Lond.), vol. 486 (Pt 2), juillet 1995, p. 517–22 [texte intégral, lien PMID]
- A Marchlewska-koj, A Caretta, C Mucignat-Caretta, P Olejniczak, « Stimulation of estrus in female mice by male urinary proteins », dans Journal of Chemical Ecology, vol. 26, no 10, octobre 2000, p. 2355–65 [lien DOI]
- J Krieger, A Schmitt, D Löbel, et al., « Selective activation of G protein subtypes in the vomeronasal organ upon stimulation with urine-derived compounds », dans The Journal of Biological Chemistry, vol. 274, no 8, février 1999, p. 4655–62 [lien PMID, lien DOI]
- Aggression protein found in mice, BBC News, (5 December 2007). Consulté le 26 September 2009
- JL Knopf, JF Gallagher, WA Held, « Differential, multihormonal regulation of the mouse major urinary protein gene family in the liver », dans Molecular and Cellular Biology, vol. 3, no 12, décembre 1983, p. 2232–40 [texte intégral, lien PMID]
- DH Robertson, JL Hurst, MS Bolgar, SJ Gaskell, RJ Beynon, « Molecular heterogeneity of urinary proteins in wild house mouse populations », dans Rapid Communications in Mass Spectrometry, vol. 11, no 7, 1997, p. 786–90 [lien PMID, lien DOI]
- DH Robertson, KA Cox, SJ Gaskell, RP Evershed, RJ Beynon, « Molecular heterogeneity in the Major Urinary Proteins of the house mouse Mus musculus », dans The Biochemical Journal, vol. 316, no Pt 1, mai 1996, p. 265–72 [texte intégral, lien PMID]
- SA Cheetham, AL Smith, SD Armstrong, RJ Beynon, JL Hurst, « Limited variation in the major urinary proteins of laboratory mice », dans Physiology & Behavior, vol. 96, no 2, février 2009, p. 253–61 [lien PMID, lien DOI]
- Brennan PA, « On the scent of sexual attraction », dans BMC Biol, vol. 8, no 1, mai 2010, p. 71 [texte intégral, lien PMID, lien DOI]
- SA Roberts, DM Simpson, SD Armstrong, et al., « Darcin: a male pheromone that stimulates female memory and sexual attraction to an individual male's odour », dans BMC Biol, vol. 8, no 1, juin 2010, p. 75 [lien PMID, lien DOI]
- Moskowitz, C, « Biologists Learn Why Mice Go Gaga for Urine », FoxNews.com, FOX News Network, 3 June 2010. Consulté le 9 June 2010
- JL Hurst, CE Payne, CM Nevison, et al., « Individual recognition in mice mediated by major urinary proteins », dans Nature, vol. 414, no 6864, décembre 2001, p. 631–34 [lien PMID, lien DOI]
- MD Thom, P Stockley, F Jury, WE Ollier, RJ Beynon, JL Hurst, « The direct assessment of genetic heterozygosity through scent in the mouse », dans Current Biology, vol. 18, no 8, avril 2008, p. 619–23 [lien PMID, lien DOI]
- F Papes, DW Logan, L Stowers, « The Vomeronasal Organ Mediates Interspecies Defensive Behaviors through Detection of Protein Pheromone Homologs », dans Cell, vol. 141, no 4, mai 2010, p. 692–703 [texte intégral, lien PMID, lien DOI]
- I Rodriguez, « The chemical MUPpeteer », dans Cell, vol. 141, no 4, mai 2010, p. 568–70 [lien PMID, lien DOI]
- Why mice fear the smell of cats, BBC News, (17 May 2010). Consulté le 18 May 2010
- Ehrenberg, Rachel : Fight or flee, it's in the pee (5 June 2010).
- Bhanoo, Sindya : When a Mouse Smells a Rat (17 May 2010).
- Lascombe MB, Grégoire C, Poncet P, et al., « Crystal structure of the allergen Equ c 1. A dimeric lipocalin with restricted IgE-reactive epitopes », dans The Journal of Biological Chemistry, vol. 275, no 28, juillet 2000, p. 21572–77 [lien PMID, lien DOI]
- (en) R Lockey, DK Ledford, Allergens and Allergen Immunotherapy, Informa Health Care, 2008 (ISBN 978-1-4200-6197-0), « Mammalian Allergens », p. 201–218
- T Virtanen, T Zeiler, R Mäntyjärvi, « Important animal allergens are lipocalin proteins: why are they allergenic? », dans Int. Arch. Allergy Immunol., vol. 120, no 4, décembre 1999, p. 247–58 [lien PMID, lien DOI]
- JR Lorusso, S Moffat, JL Ohman, « Immunologic and biochemical properties of the major mouse urinary allergen (Mus m 1) », dans The Journal of Allergy and Clinical Immunology, vol. 78, no 5 Pt 1, novembre 1986, p. 928–37 [lien PMID, lien DOI]
- RD Cohn, SJ Arbes, M Yin, R Jaramillo, DC Zeldin, « National prevalence and exposure risk for mouse allergen in US households », dans The Journal of Allergy and Clinical Immunology, vol. 113, no 6, juin 2004, p. 1167–71 [lien PMID, lien DOI]
- Phipatanakul W, Eggleston PA, Wright EC, Wood RA, « Mouse allergen. I. The prevalence of mouse allergen in inner-city homes. The National Cooperative Inner-City Asthma Study », dans The Journal of Allergy and Clinical Immunology, vol. 106, no 6, décembre 2000, p. 1070–74 [lien PMID, lien DOI]
- T Perry, E Matsui, B Merriman, T Duong, P Eggleston, « The prevalence of rat allergen in inner-city homes and its relationship to sensitization and asthma morbidity », dans The Journal of Allergy and Clinical Immunology, vol. 112, no 2, août 2003, p. 346–52 [lien PMID, lien DOI]
- RA Wood, « Laboratory animal allergens », dans ILAR Journal, vol. 42, no 1, 2001, p. 12–16 [lien PMID]
- JM Gaffin, W Phipatanakul, « The role of indoor allergens in the development of asthma », dans Current Opinion in Allergy and Clinical Immunology, vol. 9, no 2, avril 2009, p. 128–35 [lien PMID, lien DOI]
- JA Pongracic, CM Visness, RS Gruchalla, R Evans, HE Mitchell, « Effect of mouse allergen and rodent environmental intervention on asthma in inner-city children », dans Annals of Allergy, Asthma & Immunology, vol. 101, no 1, juillet 2008, p. 35–41 [lien PMID, lien DOI]
- S Gordon, R Preece, « Prevention of laboratory animal allergy », dans Occupational Medicine, vol. 53, no 6, septembre 2003, p. 371–77 [lien PMID, lien DOI]
- TA Platts-Mills, J Longbottom, J Edwards, A Cockroft, S Wilkins, « Occupational asthma and rhinitis related to laboratory rats: serum IgG and IgE antibodies to the rat urinary allergen », dans The Journal of Allergy and Clinical Immunology, vol. 79, no 3, mars 1987, p. 505–15 [lien PMID, lien DOI]
- Gregoire C, Rosinski-Chupin I, Rabillon J, Alzari PM, David B, Dandeu JP, « cDNA cloning and sequencing reveal the major horse allergen Equ c1 to be a glycoprotein member of the lipocalin superfamily », dans The Journal of Biological Chemistry, vol. 271, no 51, décembre 1996, p. 32951–59 [lien PMID, lien DOI]
- Hui X, Zhu W, Wang Y, et al., « Major urinary protein-1 increases energy expenditure and improves glucose intolerance through enhancing mitochondrial function in skeletal muscle of diabetic mice », dans The Journal of Biological Chemistry, vol. 284, no 21, mai 2009, p. 14050–57 [lien PMID, lien DOI]
- Zhou Y, Jiang L, Rui L, « Identification of MUP1 as a regulator for glucose and lipid metabolism in mice », dans The Journal of Biological Chemistry, vol. 284, no 17, avril 2009, p. 11152–59 [lien PMID, lien DOI]
- Portail de la biochimie
- Portail des odeurs, des senteurs et du parfum
Wikimedia Foundation. 2010.