- Acide squarique
-
Acide squarique 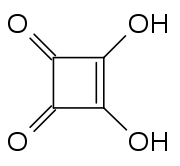
Général Nom IUPAC 3,4-dihydroxycyclobut-3-ène-1,2-dione No CAS No EINECS No RTECS PubChem SMILES InChI Propriétés chimiques Formule brute C4H2O4 [Isomères] Masse molaire[1] 114,0563 ± 0,0045 g·mol-1
C 42,12 %, H 1,77 %, O 56,11 %,Propriétés physiques T° fusion 293 °C (décomposition) [2] Thermochimie ΔfH0gaz -515 kJ·mol-1 [3] ΔfH0solide -598,2 kJ·mol-1 [3] Cp 121,6 J·K-1·mol-1 (solide,41,85 °C)[3] PCI -1 261,67 kJ·mol-1 [3] Précautions Directive 67/548/EEC[2] 
XiPhrases R : 36/37/38, 43, Phrases S : 26, 36, Unités du SI & CNTP, sauf indication contraire. L'acide squarique aussi appelé acide quadratique est un composé organique de formule brute C4H2O4. Il doit ses noms au fait qu'il est formé de quatre atomes de carbone disposés approximativement en carré ("square" en anglais, lui-même issu de l'ancien français esquarre, équerre).
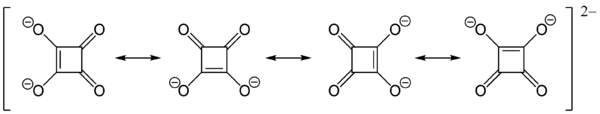
La première base conjuguée de l'acide squarique est l'anion hydrogénosquarate, C4HO4– et la suivante est l'anion divalent squarate, C4O42–.
L'acide squarique est un réactif pour la synthèse organique, utilisé par exemple pour faire des colorants squaraine (en) photosensibles et des inhibiteurs des enzymes tyrosine phosphatase (en).
Sommaire
Propriétés physico-chimiques
L'acide squarique est une poudre cristalline blanche. Sa structure ne contient pas un carré parfait car les longueurs de ses liaisons carbone-carbone ne sont pas exactement égales.
La forte acidité (pKa1 = 1,5 et pKa2 = 3,4) de ses protons est attribuable à la stabilisation par résonance des anions[4]. Dans le dianion, les charges négatives sont délocalisées équitablement entre les quatre atomes d'oxygène, ainsi l'ion squarate est totalement symétrique -contrairement à l'acide squarique lui-même- avec toutes les longueurs de liaisons C-C et C-O identiques :
D'autre part, en mécanique quantique, la façon de décrire le dianion est de placer les électrons π des doubles liaisons C=O sur les atomes d'oxygène qui deviennent donc des anions. Cela se traduit par une charge négative sur ces atomes avec un double charge positif sur le cycle d'atomes de carbone. De cette façon, le cycle respecte la règle de Hückel (2 électrons π = 4n + 2 avec n = 0) afin d'être aromatique. En conséquence, la symétrie parfaite du squarate est due à cette répartition des charges et à l'aromaticité du cycle.
Production et synthèse
La synthèse originale démarre par la réaction du 1-chloro-1,2,2-trifluoroéthylène avec le zinc pour former du perfluorocyclobutène. Ce composé est converti en 1,2-diéthoxy-3,3,4,4-tétrafluoro-1-cyclobutène par l'éthanol. Une hydrolyse donne l'acide squarique[5].
Utilisation
En médecine, il peut être utilisé pour le traitement de verrues.[réf. nécessaire] Il est également utilisé pour le traitement de l'alopécie (alopecia areata) et de alopécie totale (en) (alopecia totalis/universalis), une perte de cheveux auto-immune via une immunothérapie topique qui entraine l'apparition d'une éruption cutanée allergique[6].
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Squaric acid » (voir la liste des auteurs)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Squaric acid sur Sigma-Aldrich.com
- (en) « 3-Cyclobutene-1,2-dione, 3,4-dihydroxy- » sur NIST/WebBook, consulté le
- New Aromatic Anions. III. Molecular Orbital Calculations on Oxygenated Anions, Robert West, David L. Powell, J. Am. Chem. Soc., 1963, 85(17), 2577-2579.
- J. D. Park, S. Cohen, and J. R. Lacher, « Hydrolysis Reactions of Halogenated Cyclobutene Ethers: Synthesis of Diketocyclobutenediol », dans J. Am. Chem. Soc., vol. 84, no 15, 1962, p. 2919–2922 [lien DOI]
- A. M. Holzer, L. L. Kaplan, W. R. Levis, « Haptens as drugs: contact allergens are powerful topical immunomodulators », dans J. Drugs. Dermatol., vol. 5, no 5, 2006, p. 410–416
Voir aussi
Catégories :- Produit chimique irritant
- Acide organique
- Cétone
- Énol
- Cyclobutène
- Diol
Wikimedia Foundation. 2010.